Валентные электроны металлов главных подгрупп являются ключевым аспектом, определяющим химическую активность и свойства данных элементов. Главные подгруппы, также известные как s- и p-блок периодической системы элементов, включают элементы с атомными номерами от 1 до 20 и от 31 до 38, а также от 49 до 56 и от 81 до 88.
С точки зрения электронной структуры, валентными электронами металлов главных подгрупп являются электроны, находящиеся в s- и p-орбиталях на самом высоком уровне энергии. Например, у элемента кислорода (атомный номер 8), существует 6 валентных электронов, размещенных на трех p-орбиталях. У металлов главных подгрупп, валентные электроны могут быть разделены на две группы - электроны с самыми высокими энергиями, которые находятся в s-орбиталях, и остальные валентные электроны, находящиеся в p-орбиталях.
Валентные электроны металлов главных подгрупп играют существенную роль в реакциях данных элементов с другими веществами. Их поведение определяет способность элемента образовывать связи с другими атомами и молекулами, а также возможность участия в реакциях окисления-восстановления. Связанная с этим активность может быть использована в различных областях, включая катализ и электрохимию.
Классификация металлов
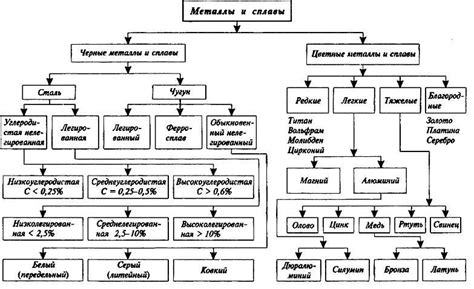
Металлы могут быть классифицированы по различным критериям, включая их структуру, свойства и распространенность в природе. Существует несколько основных классификаций металлов, основанных на их электронной структуре и химических свойствах.
Одной из основных классификаций металлов является деление на основные металлы и переходные металлы. Основные металлы, такие как железо, алюминий и медь, имеют простую кристаллическую структуру и характеризуются хорошей проводимостью электричества и тепла. Переходные металлы, такие как железо, никель и медь, имеют более сложную электронную структуру и характеризуются широким диапазоном химических свойств.
Еще одной важной классификацией металлов является деление на главные и побочные металлы. Главные металлы, такие как железо, алюминий и медь, имеют высокую электропроводность и широко используются в промышленности. Побочные металлы, такие как свинец, цинк и кадмий, имеют более низкую электропроводность и меньшую промышленную значимость.
Еще одной классификацией металлов является деление на щелочные, щелочноземельные и активные металлы. Щелочные металлы, такие как литий, натрий и калий, легко реагируют с водой и характеризуются высокой активностью. Щелочноземельные металлы, такие как магний, кальций и стронций, имеют среднюю активность и широко используются в производстве сплавов. Активные металлы, такие как цинк, железо и алюминий, также имеют высокую активность и широко используются в различных отраслях промышленности.
Особенности главных подгрупп

Главные подгруппы – это элементы периодической системы, расположенные в главных группах, от 1 до 18, и относящиеся к блокам s и p. Они включают элементы групп 1-2 и 13-18, а также элементы крысной группы 12.
Первая главная подгруппа включает щелочные металлы – литий, натрий, калий и др. Они обладают одной валентной электронной оболочкой и характеризуются высокой активностью при реакциях. Например, алкалиметаллы вступают в реакцию с водой с образованием щелочи и выделением водорода.
Вторая главная подгруппа представляет элементы земного щелочного металлы, такие как магний, кальций, стронций и др. У них две валентные электронные оболочки и они химически более активны, чем элементы первой главной подгруппы. Земнощелочные металлы используются в различных сферах, включая производство сплавов и различные химические процессы.
Третья главная подгруппа включает элементы группы 13, включающие алюминий, галлий, индий и др. Алюминий – один из самых распространенных элементов, используется в строительстве, авиации и других отраслях. Группа 13 элементов обладает тремя валентными электронными оболочками и характеризуется способностью образовывать стойкие комплексы.
Последние четыре главные подгруппы содержат элементы групп 14-17. Четвертая подгруппа включает углерод, кремний, германий и др. Они обладают по 4 валентным электронным оболочкам и обладают свойствами полуметаллов. Пятая поргруппа включает азот, фосфор, антимон и др. Главные представители этой группы обладают пятью валентными электронными оболочками и могут принимать отрицательные заряды. Шестая подгруппа включает кислород, серу, селен и др. Они имеют по 6 валентным электронным оболочкам и образуют анионы с отрицательным зарядом.
Седьмая главная подгруппа включает галогены – фтор, хлор, бром и др. Они обладают семью валентными электронными оболочками и характеризуются своими высокими химическими активностью. Эти элементы используются в качестве стерилизаторов, дезинфицирующих средств и других химических процессах.
Свойства валентных электронов

Валентные электроны - это электроны на внешней энергетической оболочке атома металла. Они находятся на самом высокоэнергетическом уровне и являются ответственными за химические свойства металла.
Одним из важных свойств валентных электронов является подвижность. Валентные электроны в металлах могут свободно перемещаться по кристаллической решетке, что обеспечивает электрическую и теплопроводность металлов.
Другим важным свойством валентных электронов является их участие в химических реакциях. Валентные электроны металлов главных подгрупп активно взаимодействуют с другими атомами и ионами, образуя химические связи. Благодаря этому свойству, металлы главных подгрупп могут образовывать различные соединения и применяться в различных отраслях промышленности.
Важным аспектом свойств валентных электронов является их спин. Электроны могут иметь направление спина вверх или вниз, что влияет на их поведение в магнитных полях и обладает значительным значением в области магнитизма и электроники.
Влияние валентных электронов на свойства металлов
Валентные электроны металлов главных подгрупп являются основной причиной их уникальных свойств. Именно количество и активность валентных электронов определяют реакционную способность металлов, их проводимость тепла и электричества, а также магнитные и оптические свойства.
Количество валентных электронов в атоме металла влияет на его реакционную активность. Металлы с большим числом валентных электронов имеют большую способность образовывать химические связи, что делает их более реакционноспособными. Такие металлы способны образовывать разнообразные химические соединения и проводить различные химические реакции.
Проводимость тепла и электричества является одним из важнейших свойств металлов, и это свойство также определяется валентными электронами. Валентные электроны обладают свободной подвижностью и способны легко передвигаться внутри металлического кристалла. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью.
Магнитные и оптические свойства металлов также зависят от валентных электронов. Валентные электроны могут создавать магнитные моменты, что делает металлы магнитными. Кроме того, валентные электроны участвуют в оптических переходах, что влияет на их способность поглощать и испускать свет.
Итак, можно сказать, что валентные электроны играют ключевую роль в определении свойств металлов. Благодаря им металлы обладают реакционной активностью, высокой проводимостью тепла и электричества, а также магнитными и оптическими свойствами. Понимание роли валентных электронов позволяет разрабатывать новые материалы с улучшенными свойствами и применением в различных промышленных областях.
Химические свойства металлов главных подгрупп

Металлы главных подгрупп характеризуются разнообразными химическими свойствами, обусловленными особенностями их электронной структуры. Валентные электроны, находящиеся на внешнем электронном уровне, играют важную роль в химических реакциях данных элементов.
Валентные электроны металлов главных подгрупп обладают высокой подвижностью и способностью к образованию ионов с положительным зарядом. Это позволяет им легко вступать в химические реакции, такие как окисление, восстановление, образование соединений с другими элементами.
Металлы главных подгрупп обладают высокой химической активностью и способностью образовывать соединения с различными элементами, включая неметаллы. Например, основные металлы первой подгруппы (литий, натрий, калий) обладают высокой реакционной способностью с водой, образуя гидроксиды и выделяя водород.
Металлы главных подгрупп также способны образовывать соединения с кислородом, образуя оксиды с различной степенью окисления. Например, медь может образовывать оксиды с различным количеством атомов кислорода.
Кроме того, металлы главных подгрупп могут образовывать соединения с другими элементами, такими как сера, хлор, фосфор и другими. Эти соединения могут иметь различную степень окисления металла и различную структуру.
Некоторые металлы главных подгрупп обладают амфотерными свойствами, то есть они могут взаимодействовать с кислотами и щелочами. Например, цинк и алюминий могут взаимодействовать как с кислотами, так и с щелочами, образуя соли и гидроксиды.
Роль валентных электронов в реакциях металлов
Валентные электроны играют важную роль в реакциях металлов, определяя их химические свойства и реакционную способность. Эти электроны расположены на внешней энергетической оболочке металлического атома, и именно они участвуют в образовании химических связей и реакциях металлов.
Валентные электроны в металлах обладают свойством свободного движения, то есть они могут перемещаться по кристаллической решетке металла. Это позволяет металлам проявлять характеристики, такие как теплопроводность и электропроводность. Кроме того, это делает металлы реакционно активными, так как валентные электроны могут легко участвовать в обмене электронами с другими атомами.
Валентные электроны могут образовывать химическую связь с другими атомами, образуя ионные или ковалентные соединения. Например, металлы могут образовывать ионы положительного заряда, отдавая один или несколько валентных электронов, или электронные пары, участвуя в образовании ковалентных связей с другими атомами.
Валентные электроны также определяют химическую реакционную способность металлов. Чем больше валентных электронов у металла, тем более активным он является и тем больше он может образовывать соединений. Например, металлы с большим количеством валентных электронов обладают большей способностью к окислительным реакциям и могут образовывать большее количество стабильных соединений.
| Металл | Количество валентных электронов |
|---|---|
| Литий | 1 |
| Алюминий | 3 |
| Железо | 2 |
| Свинец | 4 |
Применение металлов главных подгрупп в промышленности

Металлы главных подгрупп, такие как литий, калий, натрий, магний, алюминий и др., нашли широкое применение в различных отраслях промышленности благодаря своим уникальным свойствам.
Литий, например, применяется в производстве аккумуляторов, так как обладает высокой энергетической плотностью и обеспечивает длительное время работы устройств. Кроме того, литий используется в производстве смазок, стекла, керамики, а также в атомной промышленности.
Калий играет важную роль в производстве удобрений, так как является необходимым элементом для роста растений. Он используется как универсальное удобрение, а также в производстве калиевых соединений, стекла, мыла и других продуктов.
Натрий находит применение в производстве стекла, мыла, мочегонных препаратов и многих других химических веществ. Он также используется в пищевой промышленности в качестве добавки для улучшения вкуса и сохранения продуктов.
Магний, благодаря своей легкости и прочности, применяется в авиационной и автомобильной промышленности. Он используется для производства компонентов двигателей, рам автомобилей, а также в производстве спортивных и бытовых товаров.
Алюминий является одним из наиболее распространенных и востребованных металлов в промышленности. Он используется в производстве легких и прочных конструкций, таких как авиационные и автомобильные детали, а также в производстве упаковочного материала, посуды и многих других товаров.
Применение металлов главных подгрупп в промышленности позволяет создавать продукты с улучшенными свойствами, обеспечивать безопасность и эффективность производства, а также создавать новые технологии и инновационные изделия.
Вопрос-ответ

Что такое валентные электроны?
Валентные электроны - это электроны, находящиеся на самом высоком энергетическом уровне в атоме металла. Они обладают наибольшей энергией связи с атомом и могут участвовать в химических реакциях и образовании химических связей.
Сколько валентных электронов у металлов главных подгрупп?
Металлы главных подгрупп имеют разное количество валентных электронов. Например, валентных электронов у металлов первой подгруппы (щёлочные металлы) всегда один, у металлов второй подгруппы (щелочноземельные металлы) всегда два, у металлов третьей подгруппы может быть от 3 до 12 валентных электронов.
Зачем нужны валентные электроны металлов главных подгрупп?
Валентные электроны металлов главных подгрупп играют важную роль в химических реакциях и свойствах данных металлов. Они обладают свойствами, позволяющими металлам образовывать ионы и связи с другими атомами, что позволяет им реагировать с различными веществами и участвовать в химических процессах.
Какие свойства имеют металлы главных подгрупп?
Металлы главных подгрупп обладают рядом общих свойств: они обладают металлическим блеском, хорошей теплопроводностью и электропроводностью, обычно имеют высокую плотность и температуру плавления, образуют катионы с положительным зарядом, и у них обычно низкий валентный номер.
