Хлор – один из самых распространенных элементов, который широко используется в различных областях науки и промышленности. Особый интерес вызывает взаимодействие хлора с металлами, в результате которого образуются хлориды металлов. Валентность хлора при этом важна и влияет на свойства образующихся хлоридов.
Валентность – это химическое свойство элемента указывать на число электронов, которое может потерять, приобрести или способен разделять для образования химических связей. Хлор, как халькоген, имеет семь электронов во внешней оболочке и может образовывать соединения с другими элементами, основываясь на этом числе. Однако, взаимодействие хлора с металлами может привести к различным валентностям хлора – от -1 до +7.
Валентность хлора при взаимодействии с металлами определяется электроотрицательностью металла и условиями реакции. В некоторых случаях хлор может приобретать отрицательную валентность, например, при образовании хлоридов, таких как NaCl, где хлор приобретает валентность -1. Однако, в других реакциях хлор может выступать в роли окислителя и иметь положительную валентность, как, например, в случае образования хлорида марганца (MnCl2) или хлорида железа (FeCl3).
Валентность хлора при реакции с металлами
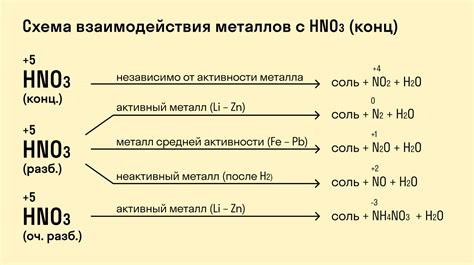
Хлор является активным не металлом, который обладает переменной валентностью при взаимодействии с металлами. Валентность хлора в данной реакции определяется его электроотрицательностью и способностью к образованию ионного связи. Взаимодействие хлора с металлами происходит путем обмена электронами, что приводит к образованию ионов хлорида.
В реакции с металлами хлор может иметь различные валентности, в зависимости от своего окружения и условий реакции. Например, взаимодействие хлора с щелочными металлами (например, натрием) приводит к образованию ионов хлорида с валентностью -1. При этом хлор получает электрон от металла, образуя отрицательный ион хлорида, который связан с положительным ионом металла через ионную связь.
Однако, с некоторыми металлами, хлор может образовывать соединения с другими валентностями. Например, сразу с несколькими металлами хлор может образовывать соединения с валентностью -3, такие как хлорид железа (III) или хлорид алюминия (III). В этих случаях хлор получает три электрона от металла, образуя трехкратно отрицательный ион хлорида.
Итак, валентность хлора при реакции с металлами может быть различной и зависит от свойств хлора и металла, а также условий реакции. Реакция взаимодействия хлора с металлами является важным химическим процессом, который имеет большое значение в промышленности и научных исследованиях.
Реакция хлора с металлами
Хлор — химический элемент, встречающийся в природе в виде хлорида натрия и других соединений. Он имеет высокую химическую активность и обладает валентностью -1. При взаимодействии с металлами хлор может образовывать различные соединения.
Самой известной реакцией хлора с металлами является образование хлоридов металлов. В этой реакции хлорники металлов отдают свои заряды и образуют ионы металла со стабильной валентностью. Например, хлор может реагировать с натрием, образуя натрий хлорид (NaCl) — соль, широко используемую в пищевой и химической промышленности.
Некоторые металлы, такие как железо или алюминий, могут реагировать с хлором при повышенных температурах. В результате образуются более сложные хлориды, например, хлорид железа (FeCl3) или хлорид алюминия (AlCl3). Эти соединения широко используются в различных отраслях промышленности, таких как производство красителей и лекарственных препаратов.
Также хлор может образовывать комплексные соединения с металлами, в которых присутствуют ионы хлора и координационная сфера металла. Например, может образовываться комплекс хлорида кобальта (CoCl2) с двумя ионами хлора и двумя молекулами воды. Это соединение используется в качестве индикатора реакций, а также в производстве фоточувствительных материалов.
Таким образом, реакция хлора с металлами может привести к образованию различных соединений, от простых хлоридов до сложных комплексов. Эти соединения широко используются в различных сферах промышленности и науки и играют важную роль в обеспечении наших повседневных потребностей.
Валентность хлора в соединениях с металлами
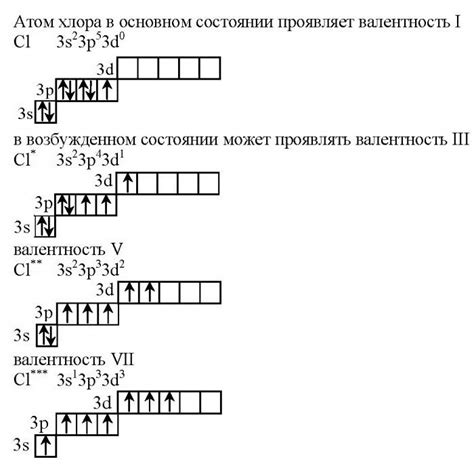
Хлор – химический элемент, который может образовывать соединения с различными металлами. В таких соединениях валентность хлора может быть различной и зависит от химической природы металла, его электронной конфигурации и условий реакции.
Соединения хлора с металлами могут иметь различные степени окисления хлора. Наиболее распространенными являются соединения с +1, +3, +4, +5 и +7 степенями окисления хлора.
Одним из наиболее известных соединений хлора с металлами является хлорид натрия (NaCl). В этом соединении хлор имеет валентность -1, в то время как натрий имеет валентность +1. Ионы хлора и натрия образуют кристаллическую решетку, которая является структурной единицей соли.
Ещё одним примером может служить хлорид железа (FeCl3), в котором хлор имеет валентность +3, а железо – валентность +3. Это соединение широко используется в качестве катализатора и в процессе синтеза органических соединений.
Валентность хлора в соединениях с металлами в значительной степени определяется электроотрицательностью хлора. Чем выше электроотрицательность хлора, тем выше его валентность в соединении с металлом. Однако, необходимо учитывать и другие факторы, такие как размер металла и его электронная конфигурация, которые могут оказывать влияние на валентность хлора.
Примеры валентности хлора в соединениях с металлами
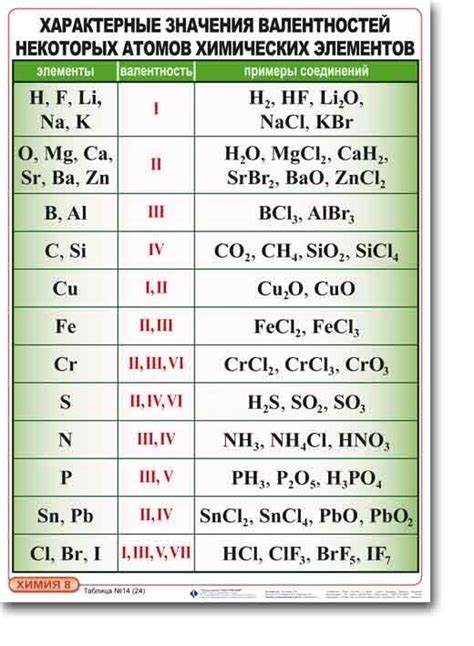
Хлор (Cl) является одним из самых химически активных халогенов и может образовывать соединения с металлами различных валентностей. Валентность хлора в таких соединениях определяется его электроотрицательностью и способностью переходить от валентностей -1 до +7.
Примером соединения, в котором валентность хлора равна -1, является хлорид натрия (NaCl). В этом соединении хлор и натрий образуют ионные связи, где хлорида воспринимается как анион с валентностью -1, а натрия - как катион с валентностью +1.
Валентность хлора +1 можно наблюдать в соединении хлорида серебра (AgCl). Здесь хлор и серебро образуют ионные связи, где анион хлорида имеет валентность -1, а катион серебра имеет валентность +1.
Наиболее высокие валентности хлора, такие как +5, +6 и +7, встречаются в хлоратах кислородосодержащих кислотных оксидов, например, в перхлоратах и перхлоратных кислотах. В этих соединениях хлор образует ковалентные связи с кислородом и имеет положительную валентность.
Таким образом, валентность хлора при его взаимодействии с металлами может быть различной и зависит от условий и типа соединения. Хлор может проявлять как отрицательные, так и положительные валентности, что делает его универсальным для образования разнообразных соединений с металлами.
Практическое применение соединений хлора с металлами

Хлор, являясь одним из наиболее распространенных химических элементов, находит широкое применение во многих областях, включая промышленность, сельское хозяйство и медицину. Его валентность при взаимодействии с металлами позволяет получать различные химические соединения, которые активно используются в разных отраслях.
Одним из важных практических применений соединений хлора с металлами является производство хлор-щелочной промышленности. При этом процессе хлор взаимодействует с металлическими электродами, такими как ртуть или сталь, в электролитических ячейках. Результатом этого взаимодействия является получение основных химических продуктов: щелочи (натрия или калия) и хлора.
Кроме того, соединения хлора с металлами активно используются в области водоочистки и обработки воды. Хлор в сочетании с металлическими ионами используется как дезинфицирующее средство для уничтожения бактерий, вирусов и других микроорганизмов в воде. Такие соединения обладают мощным биоцидным действием и позволяют поддерживать высокое качество питьевой воды и воды в бассейнах.
Ρри взаимодействии хлора с металлами также происходит образование специфических комплексных соединений. Такие соединения находят применение в качестве катализаторов в различных химических процессах. Медь, железо, никель и другие металлы играют важную роль в катализе, ускоряя реакции и облегчая процессы получения различных продуктов.
Таким образом, практическое применение соединений хлора с металлами связано с производством щелочных продуктов, водоочисткой и катализом. Химические соединения хлора с металлами играют важную роль в промышленности, сельском хозяйстве, медицине и других сферах деятельности человека.
Вопрос-ответ

Какие металлы реагируют с хлором?
Хлор образует соединения с большинством металлов, включая щелочные, щелочно-земельные и несколько переходных металлов.
Какова валентность хлора при взаимодействии с щелочными металлами?
При взаимодействии с щелочными металлами, хлор обычно имеет валентность -1.
Какова валентность хлора при взаимодействии с щелочно-земельными металлами?
При взаимодействии с щелочно-земельными металлами, хлор обычно имеет валентность -1 или -2.
Какова валентность хлора при взаимодействии с переходными металлами?
Валентность хлора при взаимодействии с переходными металлами может быть различной и зависит от конкретного металла и условий реакции.
