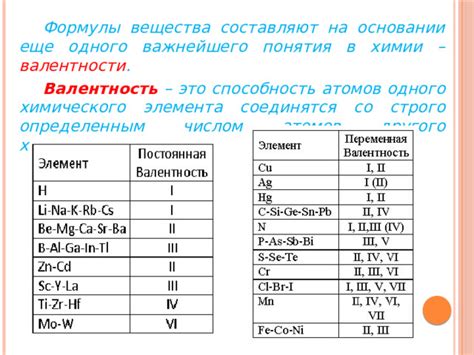
В химии валентность - это число, указывающее на число электронов, которые атом или ион может отдать или приобрести при взаимодействии с другими атомами или ионами. Валентность ионов металла имеет важное значение при определении химических свойств металлических соединений.
Формула валентности ионов металла состоит из знака металла и его валентности, заключенных в квадратные скобки. Например, для иона железа Fe3+, валентность равна +3. Для иона меди Cu2+, валентность равна +2. Ион алюминия Al3+ имеет валентность +3.
Физические свойства металлических ионов, такие как их валентность, напрямую влияют на их реакционную способность и способность образовывать соединения с другими элементами. Например, металльные ионы с положительными валентностями склонны сдавать электроны и образовывать ионы с отрицательными валентностями.
Примеры валентности ионов металла включают ион железа Fe2+ и Fe3+, ион меди Cu+ и Cu2+, ион алюминия Al3+, ион цинка Zn2+ и ион свинца Pb2+. Эти металлические ионы широко используются в различных областях, таких как промышленность, электроника и медицина.
Основные понятия валентности ионов металла
Валентность – характеристика способности атомов металла образовывать ионы определенного знака. Она определяется количеством электронов, которые атом может отдать или принять при образовании иона.
Ион – заряженная частица, образованная атомом путем потери или приобретения электронов. Ионы металлов обладают положительным зарядом и образуются путем отдачи одного или нескольких электронов.
Валентность иона – числовое значение, указывающее, сколько электронов атома металла было отдано или принято при образовании иона. Обычно выражается в римской цифре, например, Cu+2 (валентность иона меди равна двум).
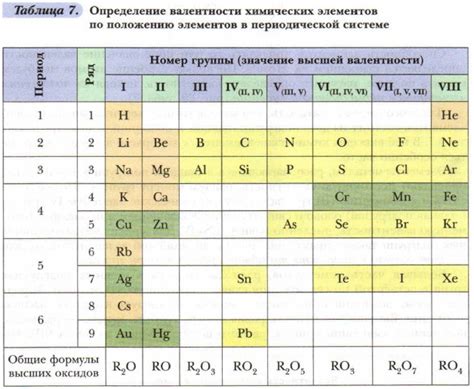
Валентность иона металла зависит от положения металла в периодической таблице. Валентность ионов может быть постоянной или переменной. Некоторые металлы имеют постоянную валентность, например, железо всегда имеет валентность +2 или +3. У других металлов, например, свинца и меди, валентность может изменяться в зависимости от условий.
Валентность металла – сумма валентностей всех ионов, образованных атомами данного металла в соединении. Она позволяет определить соотношение между ионами разных элементов в химическом соединении и применяется для составления формул химических соединений.
Определение и формула

Валентность ионов металла - это числовое значение, которое показывает количество электронов, переданных или принятых металлом при образовании ионообразующего соединения. Валентность ионов металла определяется по их способности образовывать положительные ионы.
Формула валентности ионов металла обычно записывается в виде римских цифр, которые указывают на количество переданных электронов. Например, Железо(II) означает, что железо вступило в реакцию, передавая два электрона, а Медь(I) означает, что медь вступила в реакцию, передавая один электрон.
Определение валентности ионов металла происходит на основе их положения в периодической таблице и заряда, который они приобретают при образовании ионообразующих соединений. Например, большинство металлов группы 1 имеют валентность +1, а металлы группы 2 имеют валентность +2.
Определение валентности ионов металла играет важную роль при составлении химических формул и уравнений реакций, а также при проведении расчетов в химических процессах с участием металлов.
Физическое значение валентности ионов металла
Валентность ионов металла имеет физическое значение и определяет число электронов, переданных или принятых атомом металла при образовании иона. Валентность является важным параметром, определяющим свойства вещества и его способность взаимодействовать с другими веществами.
Физическое значение валентности ионов металла связано с их электронной структурой. Ионы металла могут иметь положительную или отрицательную валентность. Положительная валентность означает, что ион металла имеет выше определенное число свободных электронов и способен передавать их другим атомам или ионам. Отрицательная валентность, наоборот, говорит о том, что ион металла имеет недостаток электронов и способен принимать их от других атомов или ионов.
Физическое значение валентности ионов металла также связано с их химической активностью. Чем выше валентность, тем больше атом металла способен вступать в химические реакции и образовывать химические соединения. Высокая валентность металла может указывать на его хорошую проводимость электричества и тепла, а также на его способность к каталитическим реакциям.
Знание физического значения валентности ионов металла позволяет предсказывать и анализировать их химические свойства, а также использовать металлы для различных промышленных и научных целей. Валентность ионов металла может быть определена с использованием химических методов и физических экспериментов, а также с помощью теоретических расчетов.
Примеры валентности ионов металла
Валентность ионов металла определяется их способностью образовывать химические связи с другими атомами. Различные металлы могут иметь разную валентность, что обусловлено их электронной структурой.
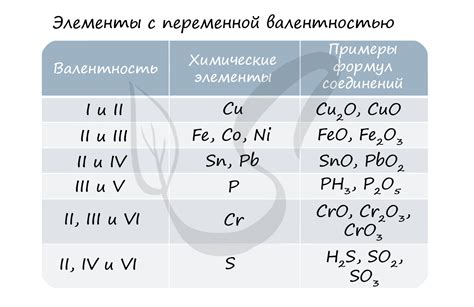
Один из примеров металлов с переменной валентностью - железо. Валентность иона железа может быть +2 или +3, в зависимости от условий окружающей среды. Например, в соединениях с кислородом (оксидах) железо обычно имеет валентность +3, например, Fe2O3.
Еще одним примером может служить медь. Валентность иона меди может быть +1 или +2. Например, в оксидах меди (Cu2O и CuO) валентность иона меди составляет +1 и +2 соответственно.
Алюминий - еще один пример металла с переменной валентностью. В оксидах алюминия (Al2O3 и AlO), валентность иона алюминия составляет +3 и +1 соответственно.
Существуют также металлы, у которых валентность непостоянна, например, марганец. В соединениях марганца можно встретить валентности от +2 до +7. Например, в оксиде марганца (Mn2O7) валентнсть марганца составляет +7.
Влияние валентности ионов металла на электрохимические процессы

Валентность ионов металла играет важную роль в электрохимических процессах. Валентность определяет, сколько электронов металл может отдавать или принимать при образовании химических соединений. Это свойство ионов металла непосредственно влияет на множество электрохимических реакций, включая электролиз, восстановление и окисление.
Ион с большей валентностью имеет большее количество электронов, которые может отдать в реакции. Это означает, что металл с более высокой валентностью может быть использован в качестве более эффективного анода при электролизе. В то же время, ионы такого металла будут более активными в окислительных реакциях, что может быть важным при производстве различных веществ.
Например, ион железа Fe3+ имеет валентность 3 и может принимать до трех электронов при реакции. Это свойство позволяет использовать его в процессах восстановления, например, при получении водорода из воды. С другой стороны, ион железа Fe2+ с валентностью 2 может быть использован в качестве анода при электролизе или в реакциях окисления, как в получении кислорода из воды.
Понимание валентности ионов металла позволяет контролировать и оптимизировать электрохимические процессы. Знание того, сколько электронов может отдать или принять ион, помогает предсказать характер реакций и подобрать оптимальные условия для проведения конкретной электрохимической реакции.
Вопрос-ответ

Что такое валентность ионов металла?
Валентность ионов металла - это число электронов, которые ион металла отдает или принимает при образовании ионного соединения.
Как определить валентность ионов металла?
Валентность ионов металла можно определить по анализу его химической формулы и расположения в периодической системе элементов.
Какая формула используется для обозначения валентности ионов металла?
Обычно валентность ионов металла обозначается в верхнем индексе справа от символа элемента в химической формуле.
Как валентность ионов металла влияет на его физические свойства?
Валентность ионов металла может влиять на его электронные, магнитные, оптические и другие физические свойства, так как определяет его способность взаимодействовать с другими веществами.
Можете привести примеры валентности ионов металла?
Натрий (Na) имеет валентность +1, магний (Mg) - +2, алюминий (Al) - +3.
