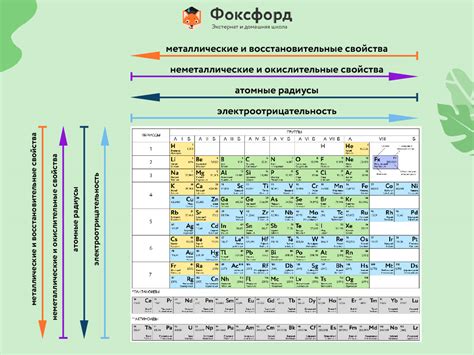
Металлы - это классические элементы Periodic table, характеризующиеся высокой тепло- и электропроводностью, а также обладающие блестящим металлическим блеском. Одной из важных характеристик металлов является их способность образовывать ионы положительного заряда, что связано с особенной структурой внешнего электронного слоя.
Внешний электронный слой у металлов обладает особенной структурой, которая предопределяет их металлические свойства. Внешний слой содержит до 10 электронов и обычно заполняется последними в процессе образования атома. Эти электроны, называемые валентными электронами, свободно перемещаются по кристаллической решетке металла, что обеспечивает высокую электропроводность.
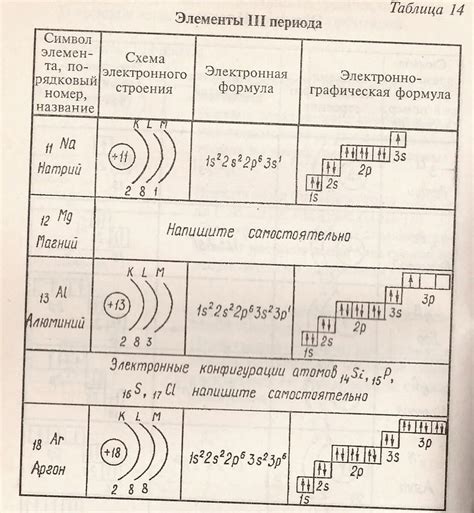
Электронную формулу внешнего слоя металлов можно записать с помощью химического обозначения компонентов. Например, для натрия (Na) внешний слой состоит из одного электрона, и его электронная формула внешнего слоя будет представлена как 1s^2 2s^2 2p^6 3s^1. Такая формула указывает на наличие одного валентного электрона, который легко отдастся во время химической реакции.
Металлы - основные элементы химической таблицы
Металлы - это основные элементы химической таблицы. Они обладают рядом характерных свойств, которые делают их уникальными и широко используемыми в различных сферах человеческой деятельности.
Во-первых, металлы обладают высокой электропроводностью, что делает их идеальными материалами для производства электроники и электротехники. Они способны эффективно проводить электрический ток по своим структурам благодаря наличию свободных электронов в их внешнем электронном слое.
Кроме того, металлы обладают высокой теплопроводностью, что позволяет им эффективно распространять тепло. Это свойство делает металлы незаменимыми материалами для изготовления теплопроводящих элементов, таких как радиаторы и теплообменники.
Еще одно важное свойство металлов - их высокая прочность и ударостойкость. Благодаря этим свойствам, металлы широко применяются в строительстве, машиностроении и автомобилестроении. Они способны выдерживать большие нагрузки и не ломаться даже при сильных ударах.
Как правило, металлы имеют блестящую поверхность и способны отражать свет. Именно поэтому их часто используют для изготовления украшений и предметов интерьера. Благодаря своей привлекательности и долговечности металлические изделия являются популярными среди дизайнеров и потребителей.
Необходимость знания электронных формул металлов

Знание электронных формул металлов является необходимым для понимания их свойств и способности взаимодействовать с другими веществами. Каждый металл имеет свою уникальную электронную структуру, которая определяет его химические и физические свойства.
Электронная формула металла представляет собой запись, описывающую количество и распределение электронов в его внешнем электронном слое. Внешняя электронная оболочка, также известная как валентная оболочка, играет ключевую роль в химических реакциях металлов.
Знание электронных формул металлов позволяет предсказывать их реакционную активность и установить закономерности в их свойствах. Например, металлы с полностью заполненным внешним электронным слоем, как основной блок таблицы Менделеева, обычно не реагируют с другими веществами, поскольку у них нет свободных электронов для образования связей.
Кроме того, электронные формулы металлов являются основой для составления химических уравнений и прогнозирования результатов химических реакций с их участием. Понимание взаимодействия валентных электронов металла и других атомов позволяет определить ожидаемые продукты реакции и предсказать ее характер (окислительную или восстановительную).
Таким образом, знание электронных формул металлов является фундаментальным для достижения глубокого понимания их химических свойств и обеспечивает основу для изучения химических реакций и прогнозирования их результатов.
Атомная структура металлов
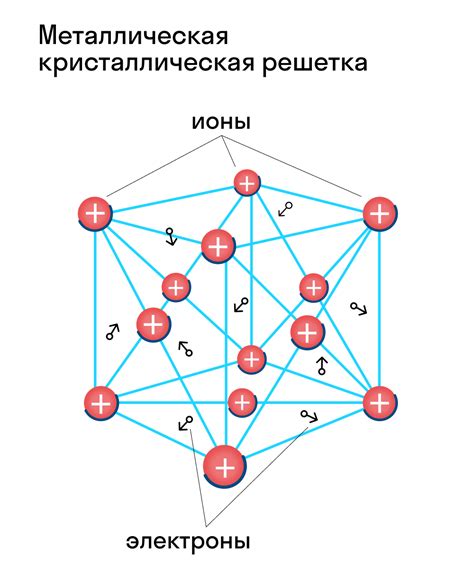
Металлы являются основными строительными блоками вещественного мира и обладают уникальной атомной структурой. Атомы металлов обладают низкой электронной аффинностью, что позволяет им легко отдавать свои внешние электроны.
Внешний электронный слой атомов металлов, называемый валентным слоем, представлен s- и p-орбиталями. Сферическая симметрия s-орбиталей и плоскостная симметрия p-орбиталей способствуют образованию кристаллической решетки в металлах.
Кристаллическая решетка на основе атомов металлов образует многочисленные плотно упакованные атомные слои, которые обладают свойством блокироваться друг другом. Это свойство позволяет металлам обладать высокой прочностью и способностью проводить ток.
Валентные электроны в металлах могут свободно двигаться внутри кристаллической решетки, образуя электронное облако, которое способствует формированию связи между атомами. Движение электронов в кристаллической решетке обуславливает термодинамические и физические свойства металлов, включая электропроводность, теплопроводность и пластичность.
Электронные формулы внешнего слоя
Электронные формулы внешнего слоя - это способ представления краткой информации о расположении электронов на внешней оболочке атома металла. Внешний слой электронов играет особую роль в химическом поведении металлов, поскольку именно эти электроны участвуют в образовании химических связей и реакциях. На основании электронных формул внешнего слоя можно сделать выводы о химической активности металла и его способности образовывать соединения.
В электронной формуле внешнего слоя после символа металла указываются только электроны, находящиеся на уровнях s и p. Эти электроны называют валентными. Например, для натрия (Na) электронная формула внешнего слоя будет выглядеть как 2-8-1, что означает, что на первом энергетическом уровне находится 2 электрона, на втором - 8 электронов, а на внешнем уровне находится 1 электрон.
С помощью электронных формул внешнего слоя можно сравнивать металлы и предсказывать их химическую активность. Например, чем меньше количество валентных электронов на внешнем слое, тем больше металл активен и склонен к образованию соединений. Это можно увидеть, сравнивая электронные формулы внешнего слоя разных элементов. Например, у лития (Li) электронная формула внешнего слоя 2-1, а у магния (Mg) - 2-8-2. Это означает, что литий активнее магния и склонен к образованию соединений с другими элементами.
Используя электронные формулы внешнего слоя, можно легко определить, сколько валентных электронов есть у данного металла и на основании этого сделать выводы о его способности образовывать соединения или принимать участие в химических реакциях. Эта информация полезна для изучения химических свойств металлов и процессов, связанных с их применением в различных отраслях промышленности и техники.
Химические свойства металлов

Металлы обладают рядом химических свойств, которые делают их особенными в сравнении с другими элементами. Во-первых, металлы активно взаимодействуют с кислородом и образуют оксиды. Это происходит благодаря электроотрицательности металла, которая позволяет ему отдавать электроны и образовывать положительные ионы.
Во-вторых, металлы обладают способностью образовывать соли, растворимые в воде. В реакции с кислотами металлы образуют соли и выделяют водород. Данная реакция является характерной реакцией металлов и помогает отличить их от неметаллов.
Также металлы могут образовывать сплавы с другими металлами. Сплавы обладают особыми свойствами, которые зависят от соотношения и химического состава компонентов. Например, бронза – это сплав меди и олова, который обладает высокой пластичностью и прочностью.
Важной химической особенностью металлов является их способность к химическому восстановлению. Металлы могут передавать свои электроны другим веществам и восстанавливаться при этом. Например, железо вступает в реакцию со свободным кислородом и образует ржавчину – оксид железа (III). Эта реакция протекает благодаря восстановлению железа.
Металлы как проводники электричества и тепла

Металлы обладают уникальными свойствами, которые позволяют им служить отличными проводниками электричества и тепла. Одним из основных свойств металлов является наличие свободных электронов в их внешнем электронном слое. Эти свободные электроны способны свободно перемещаться по кристаллической решетке металла, что делает его хорошим проводником электричества.
Когда к металлу подается электрическое напряжение, свободные электроны начинают двигаться по направлению с плюса на минус. Они создают электронный поток, который легко распространяется по всему металлическому проводнику. Благодаря этому металлы широко используются в электронике и электротехнике для создания проводов, контактов и других элементов электрических цепей.
Второе важное свойство металлов - высокая теплопроводность. Это свойство объясняется тем, что свободные электроны в металлическом проводнике могут передавать энергию в виде тепла другим электронам или атомам металла. Таким образом, тепло легко и быстро распространяется по всей металлической структуре.
Металлы с высокой теплопроводностью часто используются в технике, где требуется эффективное отвод тепла, например, в радиаторах, трубопроводах и теплообменниках. Благодаря своим уникальным свойствам металлы играют важную роль в современном мире и широко применяются в различных отраслях промышленности и науки.
Особенности связи атомов в металлах

Связь между атомами в металлах отличается особыми характеристиками по сравнению с другими типами химических соединений. Она называется металлической связью и обусловлена особым положением электронов во внешнем энергетическом уровне атомов металла.
В металлической связи электроны внешнего энергетического уровня атомов металла не принадлежат ни к одному конкретному атому, а образуют общую электронную оболочку, которая окружает положительные ионы атомов в кристаллической решетке металла. Это придает металлам особые свойства, такие как проводимость электричества и тепла, а также способность образовывать металлические блески и характерные структуры.
Металлическая связь также обеспечивает высокую пластичность и деформируемость металлов. При воздействии внешних механических сил атомы металла могут сдвигаться друг относительно друга, при этом общая электронная оболочка практически не изменяется, благодаря чему металлы могут быть легко подвергнуты различным формообразующим операциям, таким как прокатка, штамповка и тяговое формование.
Металлическую связь в металлах можно представить как сеть положительных ионов, окруженных общей электронной оболочкой. Этот тип связи позволяет атомам металла образовывать кристаллы, которые имеют отчетливую регулярную структуру и обладают высокой упорядоченностью. Такая структура дает металлам устойчивость и механическую прочность, а также влияет на их физические и химические свойства.
Влияние электронной структуры на свойства металлов
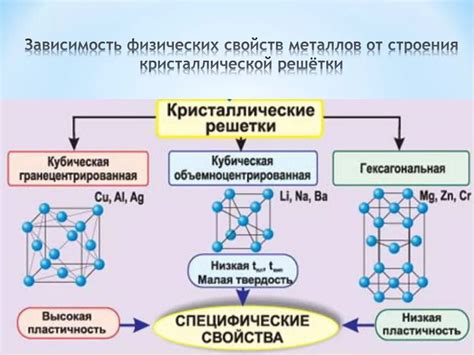
Свойства металлов, такие как проводимость электричества и тепла, пластичность и механическая прочность, в значительной мере определяются их электронной структурой внешнего электронного слоя. Внешний слой атомов металла содержит свободные электроны, которые легко двигаются по кристаллической решетке металла.
Свободные электроны обладают высокой подвижностью и способностью передавать электрический ток. Благодаря этому металлы являются отличными проводниками электричества. Именно свободные электроны ответственны за металлический блеск и отражательную способность металлов.
Электронная структура внешнего слоя также влияет на термические свойства металлов. Благодаря свободным электронам, металлы могут эффективно передавать тепло. Однако, они также могут иметь высокую термическую проводимость, что делает их хорошими материалами для использования в теплообменных установках.
Кроме того, электронная структура внешнего слоя влияет на механические свойства металлов. Свободные электроны образуют межатомные связи, которые придают металлам пластичность и способность к деформации без разрушения. Это позволяет металлам быть использованными в широком спектре сфер, включая промышленность, строительство, авиацию и электронику.
В целом, электронная структура внешнего слоя металлов играет ключевую роль в определении их свойств. Понимание этой электронной структуры может помочь в разработке новых и улучшении существующих металлических материалов с улучшенными свойствами и повышенной производительностью.
Вопрос-ответ

Какие металлы имеют электронную формулу внешнего слоя 4s2?
Металлы группы 2 периодической системы, такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba).
Какие металлы имеют электронную формулу внешнего слоя 3d10 4s2?
Металлы группы 10 периодической системы, такие как цирконий (Zr), ниобий (Nb), молибден (Mo) и тунгстен (W).
