В химии существует несколько способов представления атомов и молекул. Один из самых популярных способов - это электронные формулы, которые помогают понять строение и свойства различных веществ. Электронные формулы способны описать связи между атомами и определить, какие элементы обладают металлическими свойствами.
Важно знать, что металлы - это элементы, которые обладают характерными металлическими свойствами, такими как теплопроводность, электропроводность и гибкость. Металлы образуют особые электронные формулы, которые основываются на конфигурации электронов в их внешней оболочке.
Конфигурация электронов определяет, какие элементы являются металлами, поскольку внешние электроны определяют химические свойства вещества. В электронных формулах металлы обозначаются специальными символами и представляются в виде низкого индекса.
Установление соответствия между элементами металла и их электронными формулами требует знания периодической таблицы элементов и умения определять внешнюю оболочку каждого элемента. По схеме расположения элементов в периодической таблице можно определить, какие элементы являются металлами и какие не металлами.
Основы соответствия элементов и электронных формул металла
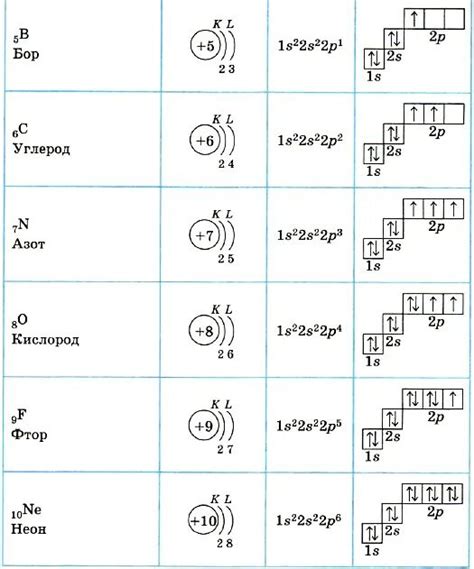
Элементы — это химические вещества, состоящие из атомов, которые обладают определенным числом протонов в ядре и имеют различное количество электронов в электронных оболочках. Металлы — это широкий класс элементов, который характеризуется высокой теплопроводностью, электропроводностью и пластичностью.
Для установления соответствия между элементами металла и их электронными формулами необходимо учитывать электронную конфигурацию атомов. Электронная конфигурация определяет распределение электронов по энергетическим уровням и подуровням атома. Она состоит из набора чисел и букв, которые описывают количество электронов на каждом уровне и подуровне.
Основные электронные оболочки атомов металлов включают s-подуровень, который может содержать максимум 2 электрона, и p-подуровень, в котором могут находиться до 6 электронов. Некоторые металлы также имеют дополнительные d- и f-подуровни, которые могут содержать до 10 и 14 электронов соответственно.
Например, атом натрия имеет электронную конфигурацию [Ne] 3s1, что означает, что у него на третьем энергетическом уровне расположен всего один электрон в s-подуровне. Это делает натрий активным металлом, который легко теряет один электрон и образует положительный ион Na+.
Соответствие между элементами металла и их электронными формулами позволяет определить их свойства и реакционную способность. Благодаря такому соответствию мы можем понять, почему некоторые металлы, например, железо и алюминий, образуют окрашенные соединения или проявляют высокую активность в реакциях с кислородом.
Значение и типы электронных формул
Электронные формулы играют важную роль в определении химических свойств и поведения металлов. Они отображают распределение электронов в атоме и позволяют установить взаимосвязь между структурой атома и его химическими свойствами.
Существует несколько типов электронных формул, каждый из которых представляет различные аспекты электронной структуры металла. Например, электронная формула Льюиса показывает количество валентных электронов металла и его способность к образованию связей с другими атомами.
Другой тип электронной формулы - энергетическая диаграмма. Она показывает энергетический уровень электронов в атоме металла и позволяет определить его возможные окислительные состояния.
Также электронные формулы могут отображать схему заполнения энергетических уровней металла. Например, формула Маллика показывает, как электроны заполняют энергетические уровни металла в порядке возрастания энергии.
Использование электронных формул помогает химикам и исследователям понять строение и свойства металлов, закономерности в химических реакциях и взаимодействиях. Это позволяет разрабатывать новые материалы с определенными свойствами и улучшать существующие технологии.
Принципы установления соответствия элетронных формул и элементов металла
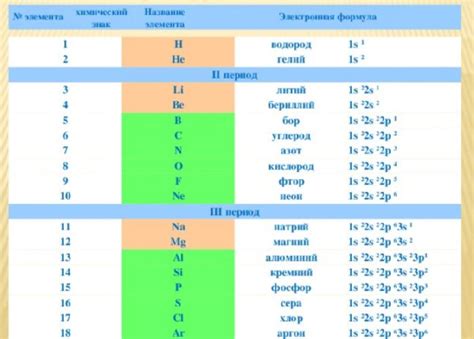
Электронная формула является представлением распределения электронов в атоме химического элемента. Она позволяет установить соответствие между количеством электронов и положительным зарядом ядра в атоме. При установлении соответствия электронных формул и элементов металла следует руководствоваться несколькими принципами.
- Учет заряда ядра. Количество электронов в атоме металла должно быть соотнесено с положительным зарядом ядра. Например, для атома металла с зарядом ядра +2 должно быть две валентные электронные пары. Именно такая комбинация электронов позволит образовать катион с двойным положительным зарядом.
- Распределение по энергетическим уровням. Электроны в химических элементах распределены по энергетическим уровням. При установлении соответствия электронных формул и элементов металла следует учитывать порядковый номер элемента в таблице, который определяет количество энергетических уровней. Например, у атома металла с порядковым номером 26 (железо) будет 26 электронов, распределенных по 4 энергетическим уровням.
- Образование ионов. Элементы металла вступают в химические реакции, образуя ионы положительного заряда (катионы). Количество электронов во внешней электронной оболочке определяет заряд катиона, образуемого атомом металла. Например, железо сформирует ион Fe2+ или Fe3+ в зависимости от количества электронов во внешней оболочке.
Установление соответствия между электронными формулами и элементами металла является важной задачей в химии. Знание принципов установления этого соответствия позволяет более глубоко понять реакционную способность и особенности химического поведения металлов.
Практические примеры соответствия элементов металла и электронных формул
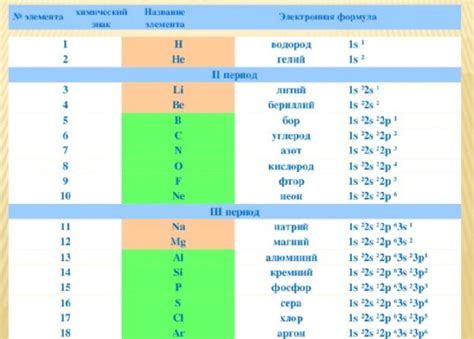
1. Железо (Fe)
Элемент железо обозначается символом Fe в таблице периодических элементов и имеет электронную формулу 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
2. Медь (Cu)
Медь имеет символ Cu в таблице периодических элементов и электронную формулу 1s2 2s2 2p6 3s2 3p6 4s1 3d10.
3. Свинец (Pb)
Символ свинец Pb в таблице периодических элементов связан с электронной формулой 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2.
4. Серебро (Ag)
Символ серебро Ag в таблице периодических элементов соответствует электронной формуле 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9.
5. Алюминий (Al)
Элемент алюминий обозначается символом Al в таблице периодических элементов и имеет электронную формулу 1s2 2s2 2p6 3s2 3p1.
6. Золото (Au)
Золото имеет символ Au в таблице периодических элементов и электронную формулу 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d10.
Вопрос-ответ

Какие элементы можно использовать для установления соответствия между металлом и его электронной формулой?
В качестве металлов можно использовать любые элементы, которые находятся в периодической таблице Менделеева и имеют атомные номера от 1 до 92.
Каким образом можно установить соответствие между металлом и его электронной формулой?
Соответствие между металлом и его электронной формулой можно установить, анализируя атомные и ионные формулы металла. Для этого нужно знать атомные номера элементов и расположение электронов в электронных оболочках атома.
Какое значение имеет электронная формула металла?
Электронная формула металла показывает распределение электронов по электронным оболочкам атома металла. Она важна для понимания химических свойств и реакций металла, а также для определения его положения в периодической таблице Менделеева.
