Оксиды металлов - это химические соединения, которые образуются при взаимодействии металлов с кислородом. Они широко применяются в различных отраслях промышленности, но для использования оксиды должны быть восстановлены до металлического состояния. Восстановление оксидов металлов - это процесс, в котором кислород отделяется от металла с помощью восстановителя.
Основными факторами, влияющими на условия восстановления оксидов металлов, являются температура, концентрация восстановителя и время воздействия. Высокая температура способствует быстрому протеканию реакции восстановления, а концентрация восстановителя определяет его активность и эффективность. Время воздействия влияет на полноту реакции и качество получаемого металла.
Существует несколько методов восстановления оксидов металлов, которые отличаются своими особенностями и применением в различных отраслях. Один из наиболее распространенных методов - термическое восстановление, при котором оксиды металлов подвергаются нагреванию до высоких температур в присутствии восстановителя. Другими методами являются электрохимическое восстановление, использование катализаторов, а также фотохимическое восстановление.
Восстановление оксидов металлов является сложным и многогранным процессом, требующим глубокого понимания химических реакций и особенностей каждого металла. Правильный выбор метода и оптимальных условий восстановления позволяет получить металлы высокого качества, используемые в различных отраслях промышленности, научных исследований и технологических процессов.
В данной статье мы рассмотрим основные факторы, которые влияют на условия восстановления оксидов металлов, а также методы, используемые для их восстановления. Мы узнаем, как температура, концентрация восстановителя и время воздействия влияют на результаты реакции, и изучим особенности каждого метода восстановления.
Оксиды металлов: основные факторы и методы восстановления
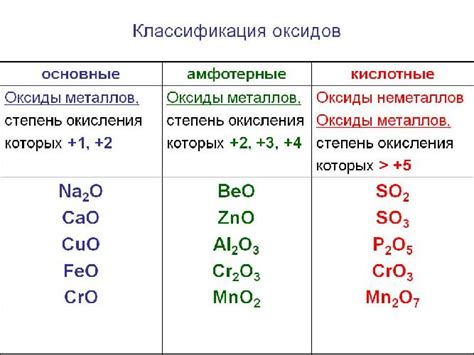
Оксиды металлов – это вещества, образующиеся при взаимодействии металлов с кислородом. Возникновение оксидов вызвано окислительными свойствами кислорода и может происходить в различных условиях. Однако, оксиды металлов являются нестабильными соединениями и могут подвергаться процессу восстановления.
Основными факторами, влияющими на способы восстановления оксидов металлов, являются тип оксида, структура и химическая активность металла, а также условия окружающей среды. Выбор метода восстановления зависит от этих факторов и требуемого качества восстановленного металла.
Существует несколько основных методов восстановления оксидов металлов. Один из них – термическое восстановление. В этом случае оксид подвергается нагреванию до определенной температуры, при которой происходит разложение оксида и восстановление металла.
Другой метод – химическое восстановление. В этом случае оксид контактирует с веществом, обладающим высокой химической активностью, которое способно передать электроны оксиду и восстановить его. Примером такого вещества может быть гидрид натрия или гидрид кальция.
Также существуют методы электрохимического восстановления и фотокаталитического восстановления оксидов металлов. В первом случае используется электрический ток для передачи электронов на оксид и его восстановления. Во втором случае восстановление оксида происходит под воздействием света, например, с помощью фотокаталитических веществ, содержащих полупроводники.
Восстановление оксидов металлов является важным процессом, который позволяет повторно использовать металл и снижать затраты на его производство. Различные методы восстановления позволяют выбирать оптимальный способ в зависимости от химических свойств оксида и требуемого результата.
Влияние температуры на восстановление оксидов металлов
Температура играет важную роль в процессе восстановления оксидов металлов. Она оказывает прямое влияние на скорость реакции и степень восстановления. При повышении температуры увеличивается активность молекул, и, следовательно, увеличивается скорость реакции восстановления.
Однако, при слишком высоких температурах может происходить испарение или испарение продуктов реакции, что может негативно сказаться на эффективности процесса. В то же время, слишком низкая температура может значительно замедлить реакцию и привести к неполному восстановлению оксидов металлов.
Оптимальная температура для восстановления оксидов металлов зависит от конкретного металла и типа оксида. Например, для восстановления оксида железа (III) к железу (II) оптимальная температура может быть примерно 900-1000°C.
Кроме того, влияние температуры может быть связано с тепловым расширением материалов. При нагревании, оксиды металлов могут расширяться, что может способствовать разрушению структуры и облегчить процесс восстановления.
Таким образом, температура является одним из ключевых факторов при восстановлении оксидов металлов и требует тщательного контроля и оптимизации для достижения максимальной эффективности процесса.
Влияние концентрации восстанавливающего агента

Концентрация восстанавливающего агента является одним из основных факторов, влияющих на процесс восстановления оксидов металлов. При низкой концентрации восстанавливающего агента скорость реакции будет невысокой, так как количество активных частиц будет недостаточным для успешного протекания процесса.
Однако при повышении концентрации восстанавливающего агента, скорость реакции также не будет равномерно увеличиваться. Вместо этого, на определенном этапе, скорость реакции достигает максимального значения, после чего дальнейшее увеличение концентрации не приводит к дополнительному ускорению процесса.
Это объясняется тем, что повышение концентрации восстанавливающего агента приводит к увеличению частоты столкновений между молекулами агента и оксидами металлов. Однако, при достижении определенной концентрации, активные центры на поверхности оксидов металлов насыщаются, и дальнейшее увеличение концентрации не приводит к дополнительной активации процесса.
Таким образом, оптимальная концентрация восстанавливающего агента должна быть определена для каждого конкретного случая в зависимости от типа оксида металла, его поверхностных свойств и условий реакции. Это позволит достичь максимальной эффективности процесса восстановления оксидов металлов.
Влияние pH среды на процесс восстановления

Реакция восстановления оксидов металлов сильно зависит от pH среды, в которой происходит процесс. pH - это мера кислотности или щелочности раствора, выраженная числовым значением. Чем выше значение pH, тем более щелочной является раствор, а чем ниже - тем более кислотной.
Восстановление оксидов металлов происходит при участии ионов водорода, которые могут быть в разных формах в зависимости от pH среды. При нейтральном pH (около 7) концентрация ионов водорода сравнительно низкая, что затрудняет процесс восстановления.
Однако, при щелочной среде (высокий pH) происходит активное восстановление оксидов металлов. Это связано с увеличением концентрации ионов водорода в растворе, что способствует более эффективному процессу восстановления.
Наоборот, при кислотной среде (низкий pH) процесс восстановления замедляется или может полностью прекратиться. Низкое содержание ионов водорода в растворе не обеспечивает необходимые условия для эффективного восстановления оксидов металлов.
Таким образом, pH среды является важным фактором, влияющим на процесс восстановления оксидов металлов. Щелочная среда способствует активному восстановлению, в то время как кислая среда замедляет или препятствует этому процессу.
Катализаторы при восстановлении оксидов металлов

Восстановление оксидов металлов – важный процесс, который может быть эффективно ускорен использованием катализаторов. Катализаторы – вещества, которые повышают скорость химической реакции, не изменяя своей концентрации. В контексте восстановления оксидов металлов, катализаторы могут быть использованы для изменения активности и селективности процесса.
Одним из наиболее распространенных катализаторов при восстановлении оксидов металлов являются драгоценные металлы, такие как платина, палладий и родий. Эти металлы обладают высокой активностью и способны эффективно ускорять процесс восстановления. Более того, катализаторы на основе драгоценных металлов могут обладать высокой стабильностью и долговечностью.
Кроме драгоценных металлов, в качестве катализаторов при восстановлении оксидов металлов могут применяться также силикаты, оксиды и нитриды различных металлов. Эти материалы обладают определенной каталитической активностью и могут быть использованы для регулирования скорости и селективности процесса. При выборе катализатора необходимо учитывать его физико-химические свойства, а также требования процесса восстановления оксидов металлов.
Важным аспектом использования катализаторов при восстановлении оксидов металлов является их влияние на кинетику реакции. Катализаторы могут ускорять процесс восстановления, снижая энергию активации реакции. Кроме того, они могут повышать селективность процесса, позволяя получить желаемый продукт с минимальным образованием побочных продуктов.
Таким образом, катализаторы играют важную роль при восстановлении оксидов металлов, позволяя ускорить процесс и повысить его эффективность. Выбор катализатора зависит от требований процесса и может быть основан на его физико-химических свойствах. В дальнейшем исследование катализаторов может привести к разработке более эффективных и стабильных материалов для восстановления оксидов металлов.
Электрохимические методы восстановления оксидов металлов

Электрохимические методы восстановления оксидов металлов являются эффективным способом преобразования окисленных форм металлов в их исходные металлические состояния. Эти методы основаны на использовании электрической энергии для преобразования химических соединений.
Один из основных электрохимических методов восстановления оксидов металлов - это электролиз. При электролизе оксид металла растворяется в электролите и металл осаждается на катоде в виде металлического отложения. Этот процесс требует применения внешнего источника электрической энергии и специального электролита, который обеспечивает проводность раствора и селективность восстановления металла.
Другим электрохимическим методом восстановления оксидов металлов является электрохимическое окисление-восстановление, или ЭХОВ. В этом методе оксид металла подвергается окислению на аноде, а затем восстанавливается на катоде, переходя в металлическую форму. ЭХОВ широко применяется в промышленности для восстановления металлов из их оксидов, таких как оксид железа (Fe2O3) или оксид алюминия (Al2O3), для получения металлических продуктов.
Электрохимические методы восстановления оксидов металлов обладают рядом преимуществ перед другими методами, такими как термическое восстановление или химическое восстановление. Они позволяют более точно контролировать процесс восстановления, обеспечивая высокую степень чистоты и эффективность получаемых металлических продуктов. Кроме того, эти методы могут быть масштабированы и применены на промышленном уровне, что делает их привлекательными для использования в различных сферах промышленности и научных исследований.
Фотокаталитические методы восстановления оксидов металлов

Фотокаталитические методы восстановления оксидов металлов являются эффективным способом превратить оксиды металлов обратно в их металлическую форму с использованием света. Эти методы основаны на использовании фотокаталитических материалов, которые могут поглощать свет и катализировать химические реакции.
Фотокаталитический процесс восстановления оксидов металлов происходит следующим образом: при освещении фотокаталитического материала светом энергия фотонов поглощается атомами металла на поверхности материала. Затем, эти атомы металла могут взаимодействовать с оксидами металлов и превратить их обратно в металлы. Таким образом, фотокаталитическая реакция позволяет восстановить оксиды металлов без необходимости использования внешних веществ или высоких температур.
Для эффективного фотокаталитического восстановления оксидов металлов необходимо использование специальных фотокаталитических материалов. Одним из наиболее известных и широко применяемых материалов является диоксид титана (TiO2), который обладает высокой фотоактивностью и стабильностью. Другими интересными фотокаталитическими материалами являются наночастицы полупроводников, такие как цинкселен (ZnSe), кремний (Si) и титанат бария (BaTiO3).
Фотокаталитические методы восстановления оксидов металлов имеют ряд преимуществ. Во-первых, они позволяют снизить энергозатраты и использование опасных веществ, таких как кислоты или щелочи. Во-вторых, эти методы можно применять для различных металлов и оксидов, что делает их универсальными и широко применимыми. Наконец, фотокаталитические методы восстановления оксидов металлов экологически безопасны и не производят вредных отходов.
В заключение, фотокаталитические методы восстановления оксидов металлов представляют собой важный и перспективный подход к решению проблемы обратного превращения оксидов металлов в металлы. Использование фотокаталитических материалов позволяет эффективно восстанавливать оксиды металлов с использованием света, что делает эти методы экологически безопасными и энергоэффективными.
Вопрос-ответ

Какие факторы влияют на условия восстановления оксидов металлов?
Условия восстановления оксидов металлов зависят от нескольких факторов, таких как температура, давление и наличие катализаторов. Кроме того, восстановление может быть поверхностным или объемным в зависимости от типа оксида.
Какие методы используются для восстановления оксидов металлов?
Для восстановления оксидов металлов используются различные методы, такие как термическое восстановление, химическое восстановление и электролиз. В каждом методе используются свои специфические условия и реакционные среды.
Какой катализатор является наиболее эффективным для восстановления оксидов металлов?
Недавние исследования показали, что платина является наиболее эффективным катализатором для восстановления оксидов металлов. Она обладает высокой активностью и стабильностью, что делает ее идеальным выбором для данной реакции.
