Коррозия металла, это процесс разрушения, вызванного химическим взаимодействием материала с окружающей средой. Она может быть причиной значительного экономического ущерба и ухудшения работы различных механизмов и конструкций. Химические методы ускорения коррозии металла играют важную роль в исследованиях и тестировании материалов, а также помогают разрабатывать методы защиты от коррозии.
Одним из самых распространенных и эффективных методов ускорения коррозии металла является использование различных химических реагентов. Они могут быть как простыми химическими соединениями, так и сложными смесями. Применение таких реагентов позволяет значительно ускорить процесс коррозии и получить результаты за более короткое время. Это особенно важно при проведении лабораторных исследований и испытаний материалов, когда необходимо изучить воздействие различных факторов на коррозию.
Применение химических методов ускорения коррозии металла также позволяет изучать эффективность различных методов защиты от коррозии. Путем нанесения защитных покрытий на металлическую поверхность и дальнейшего воздействия химических реагентов можно определить степень защиты и прочность покрытия.
Таким образом, химические методы ускорения коррозии металла являются важным инструментом для исследования и тестирования материалов, а также для разработки и оптимизации методов защиты от коррозии. Понимание и контроль коррозионных процессов позволяет экономить ресурсы и повышать надежность различных механизмов и конструкций.
Механизм ускорения коррозии металла
Ускорение коррозии металла является важным фактором в ряде промышленных процессов и технологий. Механизм ускорения коррозии заключается в увеличении скорости процесса окисления металла под воздействием химических веществ или условий, которые способствуют образованию активных реагентов.
Одним из способов ускорения коррозии является наличие агрессивных химических веществ в окружающей среде, таких как кислоты или щелочи. Эти вещества растворяют металл, ускоряя процесс его окисления и образования коррозионных продуктов. Кроме того, высокая температура окружающей среды также может способствовать ускорению коррозии.
Другим распространенным методом ускорения коррозии металла является использование электролитов. При наличии электролита в окружающей среде, металлы становятся анодами и катодами, что приводит к электрохимическим реакциям и ускорению коррозии. Электролиты могут быть представлены различными солями, водой или растворами кислот и щелочей.
Поверхностные дефекты металла, такие как царапины, трещины или поры, также способствуют ускорению коррозии. Наличие дефектов облегчает доступ окислителя к металлу и ускоряет процесс окисления. Кроме того, контакт металла с другими металлами или материалами разных электрохимических потенциалов также может приводить к ускоренной коррозии.
Важно отметить, что ускорение коррозии металла может иметь серьезные последствия в различных отраслях, таких как строительство, автомобильная промышленность и химическая промышленность. Понимание механизма ускорения коррозии и возможные способы ее предотвращения являются важными задачами для обеспечения долговечности металлических конструкций и изделий.
Влияние химических реагентов на процесс коррозии

Химические реагенты играют ключевую роль в ускорении процесса коррозии металла. Они могут быть добавлены непосредственно в окружающую среду или применяться в лабораторных условиях для моделирования подобных условий. Взаимодействие химических реагентов с металлом приводит к изменению его структуры, образованию коррозионных продуктов и ускоренной деградации материала.
Одним из наиболее распространенных химических реагентов, способствующих развитию коррозии, является кислород. Он проникает в металл и вызывает окисление его составных элементов, что приводит к изменению его химического состава и структуры. Кроме того, кислород может реагировать с образованными коррозионными продуктами, усиливая процесс разрушения металла.
Другой химический реагент, способствующий развитию коррозии, - соли. Они могут быть присутствовать в окружающей среде в виде солей растворенных в воде или добавленных специально для ускорения процесса. Соли могут усилить коррозионные процессы, создавая коррозионные ячейки на поверхности металла и активируя реакции окисления и восстановления.
Кроме кислорода и солей, химические реагенты могут включать в себя кислоты, щелочи, органические вещества и другие соединения. Их влияние на процесс коррозии может быть различным и зависит от конкретных условий. Например, кислоты могут образовывать агрессивные и едкие окружающие среды, способствующие быстрому разрушению металла, в то время как некоторые органические вещества могут образовывать защитные пленки на поверхности металла и замедлять коррозию.
В целом, понимание влияния химических реагентов на процесс коррозии помогает разработке методов защиты металлических конструкций от разрушения. Дальнейшие исследования в этой области позволят оптимизировать применение химических реагентов для контроля и уменьшения коррозии и разработать новые материалы и покрытия, обеспечивающие долговечность и надежность металлических изделий.
Коррозия при взаимодействии с кислотными средами

Коррозия металла является стойким и неприятным феноменом, особенно в условиях взаимодействия с кислотными средами. В такой среде происходит активное разрушение поверхностей металла, вызванное химическими реакциями.
Влияние кислотных сред на металл обусловлено их способностью вытягивать электроны из металлической структуры. Такое взаимодействие приводит к образованию ионов металла в растворе и освобождению водорода. Ионные реакции, такие как окисление и редукция, ускоряют процесс коррозии.
Использование кислотных сред, таких как соляная кислота или серная кислота, в промышленных процессах может привести к значительному ускорению коррозии металла. Это особенно проблематично в случае контакта с оборудованием или трубопроводами, изготовленными из металлов, подверженных коррозии, таких как сталь или алюминий.
Для защиты от коррозии в кислотных средах широко применяются различные методы. Один из них - нанесение защитных покрытий на поверхности металла, которые предотвращают проникновение кислоты и связываются с ней, образуя полимерную пленку. Также используются антикоррозионные покрытия, содержащие ингибиторы, которые замедляют реакции коррозии и предотвращают повреждение металла.
Коррозия при взаимодействии с кислотными средами является серьезной проблемой в промышленности, поэтому важно принимать меры для предотвращения и защиты от этого процесса. Контроль pH среды, использование нейтрализующих веществ и правильное обслуживание оборудования помогут минимизировать коррозию и продлить срок службы металлических конструкций и трубопроводов.
Роль хлорида натрия в ускорении коррозии металлов

Хлорид натрия, также известный как поваренная соль, играет важную роль в ускорении коррозии металлов. Это вещество, широко используемое в промышленности и быту, обладает высокой растворимостью в воде и способностью проводить электрический ток.
Когда хлорид натрия растворяется в воде, он расщепляется на ионы натрия (Na+) и ионы хлора (Cl-). Присутствие этих ионов создает агрессивную среду, которая способствует ускоренной реакции коррозии металлов.
Процесс коррозии металлов начинается с формирования оксидной пленки на поверхности металла. В присутствии хлорида натрия эта процесс усиливается, так как ионы хлора являются активными ионами и способны проникать в слой оксида, разрушая его структуру.
Кроме того, хлорид натрия обладает свойством снижать электрическую сопротивляемость оксидной пленки, что ускоряет процесс коррозии металлов. Этот процесс называется электрохимической коррозией и состоит в перемещении электронов через оксидную пленку в результате химической реакции.
Итак, роль хлорида натрия в ускорении коррозии металлов заключается в его способности создавать агрессивную среду и проникать в оксидную пленку, что в результате ускоряет процесс коррозии. Понимание этой роли позволяет разрабатывать методы защиты металлов от коррозии и снижать негативное влияние хлорида натрия в различных областях применения.
Процесс коррозии в присутствии органических кислот

Коррозия металла, как правило, происходит в присутствии влажности и кислорода. Однако, процесс коррозии может быть ускорен при соприкосновении металла с органическими кислотами. Органические кислоты обладают способностью образовывать с металлами стабильные соединения, что приводит к ускоренной процессу коррозии.
Органические кислоты, такие как уксусная, яблочная или лимонная, содержат молекулы, которые могут образовывать с металлами сложные соединения. Когда металл контактирует с органической кислотой, происходит реакция, в результате которой образуется коррозионный продукт. Этот продукт может быть более активным, чем сама кислота, и способствовать дальнейшей коррозии металла.
Процесс коррозии в присутствии органических кислот может быть особенно опасным для металлических конструкций или оборудования, используемого в промышленности или химической лаборатории. Кислотные испарения и реакции с металлом могут привести к быстрому разрушению материала и потенциальным опасностям для окружающей среды и здоровья. Поэтому важно принимать соответствующие меры предосторожности и использовать специальные защитные покрытия для защиты металла от коррозии в присутствии органических кислот.
Действие хлорида водорода на коррозию металлов

Хлорид водорода, также известный как соляная кислота, имеет сильно коррозионное действие на различные металлы. Под воздействием данного химического соединения происходит активная реакция, приводящая к ускоренной коррозии металлических поверхностей.
Хлорид водорода обладает сильным окислительным свойством и образует стойкую связь с металлами. При контакте с металлической поверхностью он проникает в поры и микротрещины, инициируя процесс коррозии. В результате хлорид водорода проникает вглубь металла и разрушает его структуру.
Особенно сильно хлорид водорода воздействует на железо и его сплавы. В процессе коррозии железа под действием этого соединения образуется хлорид железа, который ускоряет разрушение металлической поверхности. Даже небольшое количество хлорида водорода может вызвать глубокую коррозию и значительные повреждения металла.
Однако, не все металлы подвержены одинаковому действию хлорида водорода. Например, нержавеющая сталь и алюминий обладают высокой стойкостью к коррозии в условиях взаимодействия с соляной кислотой. Это объясняется их пассивностью и специфическими химическими свойствами.
Окислительно-восстановительные реакции и коррозия металлов
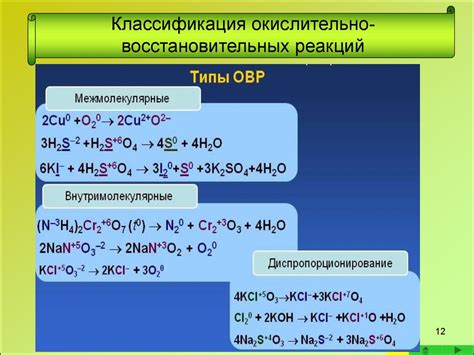
Окислительно-восстановительные реакции представляют собой основу процесса коррозии металлов. В результате этих реакций идет превращение металлического материала в его окисленные формы, что приводит к разрушению и повреждению металлической поверхности.
Коррозия металлов является химическим процессом, результатом которого является окисление металла и его превращение в соединения с оксигеном, влагой или другими веществами. Это происходит под влиянием агрессивной среды, такой как атмосферный воздух, вода, кислоты и другие химически активные вещества.
В процессе коррозии металлов происходят окислительно-восстановительные реакции между металлом и окислителем. Металл при этом действует как восстановитель, передавая свои электроны окислителю, который в свою очередь претерпевает окисление. Это приводит к образованию оксидов металла, которые обладают менее стабильной структурой и менее защищают металлическую поверхность от дальнейшей коррозии.
Помимо воздействия агрессивной среды, ускорение коррозии металлов может быть достигнуто с помощью различных химических методов. Например, использование кислотных или щелочных растворов, содержащих окислители, способствует ускоренной окислительно-восстановительной реакции и приводит к более быстрому разрушению металлической поверхности.
Таким образом, понимание окислительно-восстановительных реакций и их роли в процессе коррозии металлов является важным для разработки методов предотвращения коррозии и защиты металлических конструкций.
Вопрос-ответ

Какие химические методы можно использовать для ускорения коррозии металла?
Для ускорения коррозии металла можно использовать различные химические методы, включая погружение в агрессивные растворы, нанесение коррозионно-активных покрытий или использование электролитической коррозии.
Почему ускорение коррозии металла является важной задачей в некоторых исследованиях?
Ускорение коррозии металла является важной задачей в некоторых исследованиях для проведения более быстрых экспериментов, изучения поведения материалов в условиях, максимально приближенных к реальным, а также для разработки более эффективных методов защиты от коррозии.
Какие агрессивные растворы могут быть использованы для ускорения коррозии металла?
Для ускорения коррозии металла могут быть использованы такие агрессивные растворы, как соляная кислота, серная кислота, солянокислый раствор железа и другие.
Какие методы электролитической коррозии металла существуют?
Существуют различные методы электролитической коррозии металла, включая метод гальванической коррозии, метод анодной коррозии и метод катодной коррозии.
Какие коррозионно-активные покрытия могут быть использованы для ускорения коррозии металла?
Для ускорения коррозии металла могут быть использованы различные коррозионно-активные покрытия, включая органические пленки, солевые пленки и покрытия, содержащие анодные включения.
