Структура атома металлов является особенной и отличается от атомов других элементов. Причиной этого является специфика энергетических уровней, на которых располагаются электроны в металлических атомах. Завершение этих уровней играет ключевую роль в формировании свойств и поведения металлов.
Согласно принципу Паули, на каждом энергетическом уровне атома может находиться не более двух электронов, обладающих противоположными спинами. При заполнении энергетических уровней атома металла происходит особый процесс – заполнение "оболочек" электронами. В металлах с двумя и более электронами на последнем энергетическом уровне образуется двойная или множественная оболочка.
Завершение энергетических уровней атома металла имеет важное значение для его свойств. Образование двойной или множественной оболочки в результате заполнения электронами последнего уровня делает атом очень стабильным. Это объясняет высокую коррозионную стойкость и прочность металлов. Кроме того, завершение энергетических уровней имеет влияние на проводимость электричества и тепла, что делает металлы отличными проводниками.
Завершение энергетических уровней атома у металлов
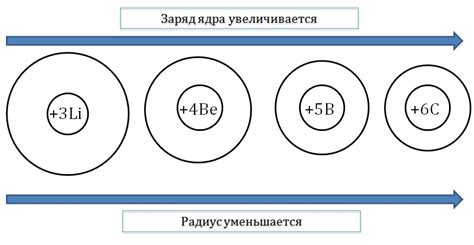
Завершение энергетических уровней атома является важной особенностью металлов. Металлы характеризуются наличием свободных электронов, которые образуют электронное облако вокруг атома. Это связано с особым строением энергетических уровней у металлов.
Энергетические уровни атома металлов заполняются по принципу Клетчатой периодической системы. Каждый энергетический уровень может вместить определенное количество электронов. Первый энергетический уровень может вместить до 2 электронов, второй - до 8 электронов, третий - до 18 электронов, и так далее.
Наиболее важными являются заполненные энергетические уровни, так как они обеспечивают стабильность атома. При завершении энергетического уровня атом металла приобретает особую устойчивость, что делает его электрически проводимым и позволяет формировать металлическую связь.
Завершение энергетических уровней атома у металлов также определяет их химические свойства. Металлы обладают высокой активностью и способностью к образованию ионов. Это связано с их способностью отдавать электроны и образовывать положительно заряженные ионы. Это является основой для многих физических и химических свойств металлов.
Атомы металлов и их энергетические уровни
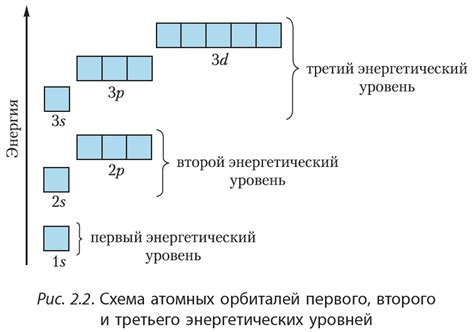
Атом металла состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, в которой находятся электроны. Количество электронов в атоме металла определяется его зарядом. Чтобы электрон перешел на более высокий энергетический уровень, ему необходимо получить энергию.
Энергетические уровни атома металла равномерно распределены и представляют собой энергетические уровни, на которых могут находиться электроны. Первый энергетический уровень является ближайшим к ядру и имеет наименьшую энергию, второй энергетический уровень находится на большем расстоянии от ядра и имеет более высокую энергию, и так далее.
Энергетические уровни атома металла определяют его химические свойства. Переход электрона с одного энергетического уровня на другой может происходить при поглощении или испускании энергии, что приводит к изменению состояния атома и его взаимодействию с окружающими веществами.
Наиболее значимыми являются внешние энергетические уровни атома металла, так как именно на них находятся свободные электроны, которые обеспечивают проводимость металлов и их другие физические свойства. Из-за свободных электронов металлы обладают высокой электропроводностью, теплопроводностью, пластичностью и другими характеристиками.
Особенности завершения энергетических уровней у металлов

Завершение энергетических уровней атома играет важную роль в химических свойствах металлов. У металлов, как правило, энергетические уровни заполняются до определенного уровня, называемого заполненным оболочкой. Это связано с особенностями строения внешней электронной оболочки, которая определяет химическое поведение металлов.
Металлы обладают малым количеством валентных электронов во внешней оболочке. Обычно у металлов внешняя оболочка заполняется полностью или почти полностью, что делает металлы стабильными и малохимически активными. Заполненная оболочка обеспечивает повышенную электронную устойчивость, что делает металлы хорошими проводниками электричества и тепла.
При отсутствии полностью заполненной оболочки у некоторых металлов могут наблюдаться более активные химические свойства. Например, у переходных металлов, таких как железо, никель или медь, внешняя оболочка не полностью заполнена, что делает их более реакционноспособными и позволяет им образовывать соединения с другими элементами.
Изучение завершения энергетических уровней у металлов имеет большое значение не только с точки зрения химии, но и применяется в различных отраслях науки и техники. Например, оно необходимо для понимания и прогнозирования свойств материалов, разработки новых сплавов, создания электронной техники и металлургических процессов.
Значение завершения энергетических уровней у металлов
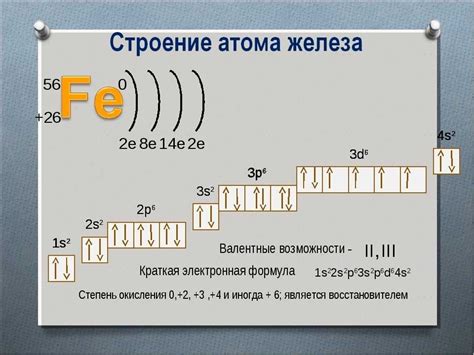
Завершение энергетических уровней атома играет важную роль в свойствах металлов. Полностью заполненные подуровни s и p внешней оболочки атома металла создают стабильное электронное окружение, что обуславливает их высокую плотность и механическую прочность.
Данная особенность также сказывается на способности металлов проводить электричество и тепло. Завершенные энергетические уровни за счет отсутствия свободных электронов позволяют электрическим зарядам свободно передвигаться по структуре металла, обеспечивая высокую электропроводность. Металлы также обладают высокой теплопроводностью, благодаря возможности быстрой передачи тепловой энергии через электронное облако атомов.
Завершение энергетических уровней у металлов дает им также устойчивость к окислительному воздействию. Так как уровни s и p полностью заполнены, отдельные атомы металла вступают в химические реакции с трудом. Поэтому металлы обладают химической инертностью и устойчивы к окислению.
Завершение энергетических уровней также имеет значение при образовании ионов металлов. В процессе ионизации металл теряет свободные электроны, но сохраняет стабильное электронное окружение в зоне внутренних оболочек. Это делает ионы металлов стабильными и способными образовывать кристаллическую решетку в металлической сетке.
Вопрос-ответ

Какие особенности имеется в завершении энергетических уровней атома у металлов?
Особенностью в завершении энергетических уровней атома у металлов является то, что они часто достигают полностью заполненных s- и p-подуровней в последней оболочке. Это делает металлы стабильными и позволяет им образовывать кристаллические решетки.
Каково значение завершения энергетических уровней атома у металлов?
Завершение энергетических уровней атома у металлов имеет большое значение, так как это позволяет металлам образовывать трехмерные кристаллические структуры, обладающие высокой прочностью и электропроводностью. Более того, завершенность оболочек атомов металлов способствует их химической инертности и стабильности.
Почему металлы имеют большую электропроводность?
Металлы имеют большую электропроводность благодаря специфическому завершению энергетических уровней и проводимости в своей последней оболочке. При завершении s- и p-подуровней атомов металлов, электроны могут свободно передвигаться между атомами, образуя "облако" электронов, которые легко переносят электрический ток.
Как металлы достигают завершения энергетических уровней в последней оболочке?
Металлы достигают завершения энергетических уровней в последней оболочке путем потери или приобретения электронов. Например, металлы группы 1 (щелочные металлы) имеют один электрон в последней оболочке и легко его отдают, чтобы достичь завершения. Металлы группы 17 (галогены) имеют семь электронов в последней оболочке и легко принимают один электрон от других атомов, чтобы достичь завершения.
