Водород – это химический элемент, который принадлежит к группе алкалиновых металлов в периодической системе. За последние годы научные исследования показали, что водород имеет замечательные свойства и может использоваться в различных областях. Одним из таких аспектов является взаимодействие водорода с оксидами металлов.
Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Они имеют широкий спектр применения – от производства стекла и керамики до применения в каталитических процессах. Кроме того, многие оксиды металлов обладают кислотными свойствами и способны реагировать с растворами щелочей. Именно в таких условиях и происходит взаимодействие с водородом.
Взаимодействие водорода с оксидами металлов возникает благодаря различным факторам. Вода является взрывоопасным соединением, взаимодействие с оксидами металлов может приводить к разрушению структуры вещества. Кроме того, оксиды металлов обладают свойствами, которые могут усилить видимость водорода и улучшить его электрохимические свойства. Исследования в этой области ведутся для определения возможности использования взаимодействия водорода с оксидами металлов в различных областях науки и промышленности.
Роль водорода в химической реакции
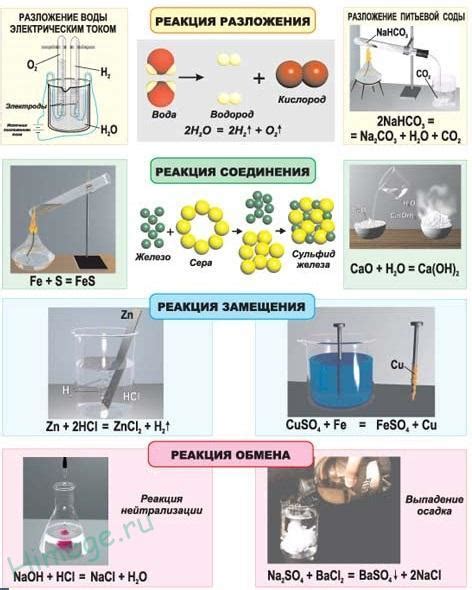
Водород – это один из самых распространенных химических элементов, играющий важную роль во многих химических реакциях, включая взаимодействие с оксидами металлов.
Взаимодействие водорода с оксидами металлов является одной из наиболее известных и широко применяемых химических реакций. При этом водород реагирует с оксидом металла, образуя воду и освобождая металл.
Оксиды металлов, в свою очередь, включают в себя десятки различных соединений, образованных металлами и кислородом. Они могут быть кислотными, основными или нейтральными по своей природе, что влияет на химическую реакцию с водородом.
В ходе реакции водород сначала образует воду, а оксид металла, являющийся окислителем, превращается в соответствующий соль металла. Результатом этой реакции обычно является выделение газа водорода и образование ионов металла.
Взаимодействие водорода с оксидами металлов активно используется в различных отраслях промышленности для получения металлов, очистки газов, синтеза различных соединений и других процессов. Например, водородная реакция широко применяется в процессе выделения металлов из их оксидов, а также в получении металлов высокой очистки. Кроме того, реакция водорода с оксидами металлов имеет большое значение в области энергетики, в том числе водородной энергетики, а также в производстве водорода в промышленных масштабах.
Водород как редокс-активное вещество
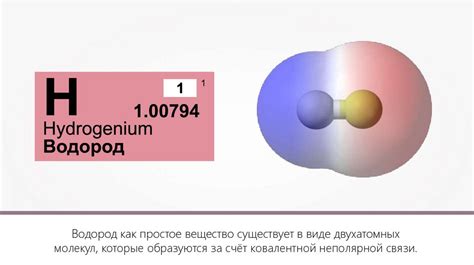
Водород является редокс-активным веществом, что означает его способность к взаимодействию с другими веществами, изменению своего окислительно-восстановительного состояния. Это свойство делает водород важным сырьем во многих процессах, включая взаимодействие с оксидами металлов.
Когда водород взаимодействует с оксидами металлов, обычно происходит реакция восстановления, то есть водород активно окисляется, а оксид металла восстанавливается. В результате такой реакции образуется металл и вода. Процесс восстановления оксидов металлов водородом применяется в различных промышленных процессах.
Водород имеет высокую энергетическую плотность, что делает его привлекательным топливом для различных видов техники и оборудования. Он может использоваться как источник энергии для автомобилей, энергетических установок и прочих устройств. Кроме того, водород является чистым и экологически безопасным видом топлива, поскольку его сгорание не выделяет вредных выбросов.
Однако, водород имеет и ряд недостатков, которые ограничивают его использование. Его надежное хранение и транспортировка требует специальных условий и оборудования. Кроме того, производство водорода само по себе является энергоемким процессом, что означает, что для его получения требуется большое количество энергии.
Водород как свободное радикальное вещество
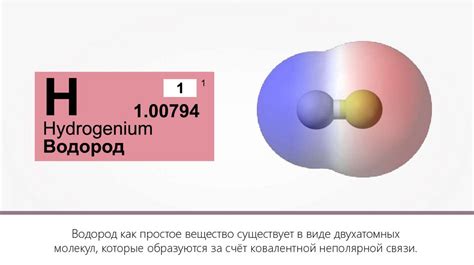
Водород (H2) является химическим элементом, который способен проявлять свойства свободного радикального вещества. Радикалы характеризуются наличием непарных электронов во внешней оболочке, что делает их очень реакционноспособными.
Свободные радикалы водорода обладают высокой активностью и могут участвовать в различных химических реакциях. Они способны образовывать химические связи с другими элементами, включая оксиды металлов.
Взаимодействие водорода с оксидами металлов происходит при нагревании или в присутствии катализатора. При этом образуются соответствующий металл и вода. Реакция может протекать как в газовой, так и в жидкой или твердой фазе.
Примером реакции водорода с оксидами металлов является восстановление оксида железа(III) (Fe2O3) до металлического железа (Fe) в присутствии водорода. Реакция происходит с выделением тепла и сопровождается изменением окраски вещества.
Водород как свободное радикальное вещество обладает значительным потенциалом в различных областях науки и техники. Он широко используется в производстве водородных топливных элементов, водородных батарей и других энергосберегающих технологиях.
Оксиды металлов и их свойства
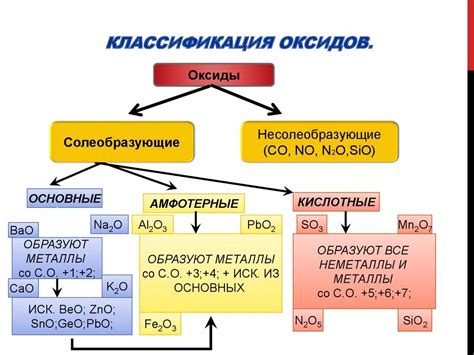
Оксиды металлов представляют собой химические соединения металла с кислородом. Они образуются в результате реакции металла с кислородом при высоких температурах или взаимодействия металла с кислородом в присутствии веществ, способствующих окислительным процессам.
Оксиды металлов обладают рядом уникальных физических и химических свойств. Некоторые из них обладают кислотными свойствами и реагируют с водой, образуя кислоты. Другие оксиды металлов являются основаниями и реагируют с кислотами, образуя соли и воду.
Некоторые оксиды металлов обладают катализаторными свойствами и используются в промышленности для ускорения различных химических реакций. Некоторые оксиды металлов обладают полупроводниковыми свойствами и используются в электронике для создания полупроводниковых приборов, таких как диоды и транзисторы.
Оксиды металлов также используются для получения металлов из руд и шлаков. Они являются важными сырьем для металлургической промышленности. Оксиды металлов широко используются в производстве стекла, керамики и эмали для придания им определенных свойств и цветов.
Химические свойства оксидов металлов
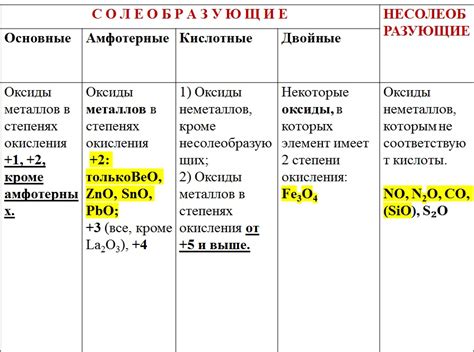
Оксиды металлов являются одними из наиболее распространенных химических соединений. Они образуются при реакции металлов с кислородом и проявляют различные свойства в зависимости от металла и его окислительных свойств.
Оксиды металлов могут быть как кислыми, так и основными соединениями. Кислые оксиды формируются при взаимодействии металлов с кислородом в кислой среде. Они обладают кислотными свойствами и способны взаимодействовать с щелочами, образуя соли и воду. Основные оксиды, напротив, образуются в щелочной среде и обладают щелочными свойствами. Они способны взаимодействовать с кислотами, образуя соли и воду.
Оксиды металлов также проявляют амфотерные свойства, то есть они могут реагировать и с кислотами, и с щелочами. Это свойство является следствием наличия в структуре оксида металла как кислотных, так и основных групп.
Химические свойства оксидов металлов позволяют использовать их в различных областях. Некоторые оксиды, например, оксид железа, используются как катализаторы в химической промышленности. Оксиды металлов также часто применяются в качестве пигментов в производстве красок и керамики.
Физические свойства оксидов металлов

Оксиды металлов - это химические соединения, которые образуются при взаимодействии металлов с кислородом. У них есть свои особенные физические свойства, которые можно использовать для определения их химических и физических характеристик.
Одним из физических свойств оксидов металлов является их температура плавления и кипения. Некоторые оксиды металлов имеют высокие температуры плавления и кипения, что делает их нерасплавимыми при нормальных условиях.
Другим важным физическим свойством оксидов металлов является их растворимость в воде и других растворителях. Некоторые оксиды металлов растворяются легко, образуя щелочные растворы, в то время как другие оксиды металлов плохо растворяются или вообще не растворяются.
Кроме того, оксиды металлов обладают электропроводностью. Некоторые оксиды металлов являются электролитами, то есть могут проводить электрический ток в расплавленном или растворенном состоянии. Это свойство используется в различных электрохимических процессах и устройствах.
Некоторые оксиды металлов обладают магнитными свойствами. Например, оксид железа - Fe2O3 - является магнитным материалом и используется в производстве магнитных записывающих устройств и магнитов.
Оксиды металлов также имеют цветные свойства. Некоторые оксиды металлов имеют яркие красные, синие или зеленые цвета, что делает их полезными для использования в качестве пигментов в красках и керамических изделиях.
В целом, физические свойства оксидов металлов зависят от состава и структуры соединений, а также от химической активности металла. Изучение этих свойств позволяет лучше понять их химические и физические свойства и использовать их в различных областях науки и техники.
Взаимодействие водорода с оксидами металлов
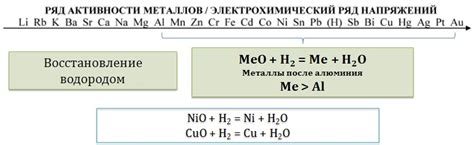
Водород является химическим элементом с атомным номером 1 в периодической системе и является самым легким элементом в природе. Взаимодействие водорода с оксидами металлов является важным процессом в химии и применяется в различных областях.
- Возможные реакции: водород может реагировать с оксидами металлов, образуя соответствующие металлы и воду. Например, реакция между водородом и оксидом алюминия приводит к образованию алюминия и воды.
- Применение в энергетике: взаимодействие водорода с оксидами металлов используется в процессе получения водородной энергии. Путем реакции между водородом и оксидами металлов, например, оксидом железа, можно получить водород, который затем можно использовать в качестве топлива для производства энергии.
- Применение в промышленности: взаимодействие водорода с оксидами металлов также имеет применение в промышленности. Например, получение металлов из их оксидов может происходить путем реакции с водородом. Этот процесс называется восстановлением и широко применяется в производстве металлов.
Взаимодействие водорода с оксидами металлов является важным процессом в химии и находит применение в различных областях, таких как энергетика и промышленность. Реакция между водородом и оксидами металлов может приводить к получению соответствующих металлов и воды. Также взаимодействие водорода с оксидами металлов используется в производстве водородной энергии и в процессе восстановления металлов из их оксидов.
Процесс восстановления оксидов металлов водородом
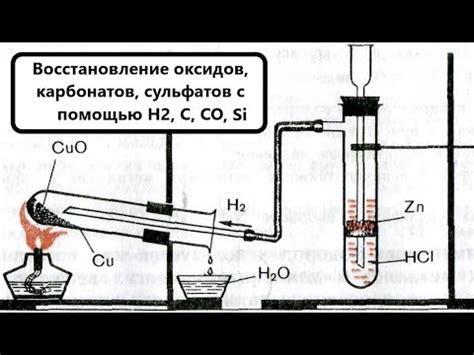
Восстановление оксидов металлов водородом - это химический процесс, при котором молекулы водорода взаимодействуют с оксидами металлов, приводя к восстановлению металла и образованию воды. Этот процесс является важной реакцией во многих промышленных и научно-исследовательских областях.
При восстановлении оксидов металлов водородом происходит переход электронов от молекул водорода на ионы металла, что приводит к снижению степени окисления металла. Реакция может протекать при различных условиях, включая высокие температуры и использование катализаторов.
Процесс восстановления оксидов металлов водородом широко применяется в производстве металлов и сплавов. Например, восстановление оксида железа водородом позволяет получить чистое железо, которое может быть использовано в производстве стали и других металлических изделий.
Также этот процесс находит широкое применение в производстве водорода. Например, восстановление оксида цинка водородом позволяет получить водородный газ, который может быть использован как энергоноситель или сырье для производства различных химических соединений.
Восстановление оксидов металлов водородом можно представить в виде химических уравнений, которые описывают реакцию между водородом и оксидом металла. Например, уравнение восстановления оксида железа водородом выглядит следующим образом:
- Fe2O3 + 3H2 -> 2Fe + 3H2O
Таким образом, процесс восстановления оксидов металлов водородом имеет широкое применение в различных отраслях, играя важную роль в производстве металлов, сплавов и водорода, а также в научных исследованиях и разработках.
Образование воды при взаимодействии водорода с оксидами металлов

Взаимодействие водорода с оксидами металлов является важной реакцией, в результате которой образуется вода. Этот процесс происходит при высоких температурах и подходит для получения чистой воды.
Оксиды металлов, такие как оксид железа, оксид алюминия или оксид магния, содержат атомы кислорода, которые имеют высокую электроотрицательность. Водород, в свою очередь, является электроотрицательным элементом. При их взаимодействии происходит реакция окисления-восстановления, в результате которой атомы кислорода из оксида металла соединяются с атомами водорода, образуя молекулы воды.
Водород при взаимодействии с оксидами металлов сначала окисляется, отдавая электроны металлу, а атомы кислорода оксида металла восстанавливаются, принимая электроны от водорода. В результате этой реакции, которую можно представить следующим образом: H2 + MxOy → H2O + MO(x-y), образуется водород и оксид металла превращаются в воду и простой металл.
Получение воды при взаимодействии водорода с оксидами металлов является важным процессом в промышленности. Кроме того, этот метод дает возможность получать воду в экологически чистом виде, так как процесс осуществляется без использования химических реагентов. Такая реакция может иметь широкое применение и привести к снижению загрязнения окружающей среды.
Вопрос-ответ

Что такое взаимодействие водорода с оксидами металлов?
Взаимодействие водорода с оксидами металлов - это процесс, при котором молекулы водорода вступают в реакцию с молекулами оксидов металлов, образуя соответствующие соединения.
Какие соединения образуются при взаимодействии водорода с оксидами металлов?
При взаимодействии водорода с оксидами металлов образуются соответствующие металлические гидриды и вода.
Как протекает реакция взаимодействия водорода с оксидами металлов?
В реакции взаимодействия водорода с оксидами металлов молекулы водорода отдают свои электроны, при этом оксиды металлов принимают эти электроны и образуются соответствующие металлические гидриды. Также образуется вода в результате реакции.
Какие металлы вступают в реакцию с водородом и образуют гидриды?
Реакцию с водородом и образование гидридов ведут большинство металлов, включая щелочные и щелочноземельные металлы, некоторые переходные металлы и редкоземельные металлы.
Какие факторы могут влиять на скорость реакции взаимодействия водорода с оксидами металлов?
Скорость реакции взаимодействия водорода с оксидами металлов может зависеть от таких факторов, как концентрация водорода и оксида металла, температура, присутствие катализаторов и давление.
