Металлы - это важная группа химических элементов, которые обладают рядом уникальных свойств. Одно из таких свойств заключается в возможности электронного переноса, что объясняет их использование в электротехнике, строительстве и многих других областях. Понимание электрохимического ряда напряжений металлов является ключом к пониманию их реакций и взаимодействий с другими веществами.
Электрохимический ряд напряжений металлов - это таблица, в которой представлены металлы в порядке убывания их стандартного электродного потенциала. Стандартный электродный потенциал - это мера способности металла отдавать или принимать электроны. Металлы, находящиеся выше в ряду, обладают большей способностью отдавать электроны, а металлы, находящиеся ниже, имеют большую способность принимать электроны.
Электрохимический ряд напряжений металлов имеет практическое применение во многих областях. Например, эта информация используется для определения, какие металлы будут коррозирующими при контакте с другими металлами. Металлы, находящиеся выше в ряду, будут коррозионно активными и будут терять электроны при контакте с металлами ниже их в ряду. Также электрохимический ряд напряжений металлов используется для определения возможности проведения электрического тока при электролизе или гальванической реакции.
Металлы и их химические свойства

Металлы – вещества, обладающие рядом характерных химических свойств, которые определяют их важную роль в жизни человека. У металлов обычно высокая тепло- и электропроводность, они обладают металлическим блеском и способностью быть полированными. Они также обладают деформируемостью, то есть могут быть легко изменены формой без разрушения своей структуры.
Одно из важных химических свойств металлов – их способность образовывать связи с другими веществами и реагировать с ними. Способность металлов образовывать ионы с положительным зарядом делает их хорошими электронными донорами. Благодаря этому свойству металлы принимают участие в различных химических реакциях, в том числе электрохимических.
Электрохимический ряд напряжений металлов позволяет определить их потенциалы окисления и положение в ряду активности относительно друг друга. Данный ряд показывает, какие металлы способны переходить в растворе из нейтрального состояния в ионное, а какие – нет. Металлы с более низкими потенциалами окисления, такие как цинк или магний, легко окисляются, выделяя электроны. Металлы с более высокими потенциалами окисления, такие как золото или платина, менее активны и мало подвержены окислению.
Знание химических свойств металлов и их электрохимического ряда напряжений является важным для понимания многих процессов, включая реакции окисления-восстановления, гальванические элементы, коррозию металлов и другие химические процессы.
Электрохимический ряд напряжений

Электрохимический ряд напряжений – это упорядоченный список металлов и полуразделов по их способности образовывать ионы в растворах и выступать в роли восстановителей или окислителей. В ряду металлы располагаются по убывающей способности отдавать электроны, а полуразделы по возрастающей способности принимать электроны. Наиболее активный металл находится в верхней части ряда, а наименее активный – в нижней.
Размещение металлов в электрохимическом ряду напряжений позволяет сделать выводы о возможности возникновения электрохимической реакции при взаимодействии двух металлов. Если металл находится выше в ряду напряжений, то он сможет вытеснить ион металла, находящегося ниже, из его соединения в растворе. Такая реакция называется реакцией вытеснения. Например, цинк, который находится выше в ряду напряжений, может вытеснить ион меди из ее соединения.
Электрохимический ряд напряжений имеет практическое применение при использовании различных металлов в анодных и катодных процессах электролиза и гальванических элементах. Электрохимический ряд также используется при решении задач в области аналитической химии для определения относительной активности различных металлов
Напряжение металлов: понятие и значение

Напряжение металлов - это величина, характеризующая способность металла выступать в качестве анода или катода в электрохимических процессах. Это свойство металлов является основой для построения электрохимического ряда напряжений металлов.
Напряжение металлов имеет важное значение в электрохимии и коррозионных процессах. Оно определяет порядок, в котором металлы окисляются или восстанавливаются при электрохимических реакциях. Чем больше напряжение металла, тем больше его склонность к окислению и низким электродам, а меньше склонность к восстановлению и высоким электродам.
Таким образом, электрохимический ряд напряжений металлов позволяет определить, какие металлы могут использоваться в качестве анодов и катодов при построении гальванических элементов и электролизеров. Например, в электролизере меди медь (Cu) выступает в качестве анода, так как ее напряжение выше, чем напряжение водорода (H2), которое выступает в качестве катода.
Роль энергии активации в химических реакциях
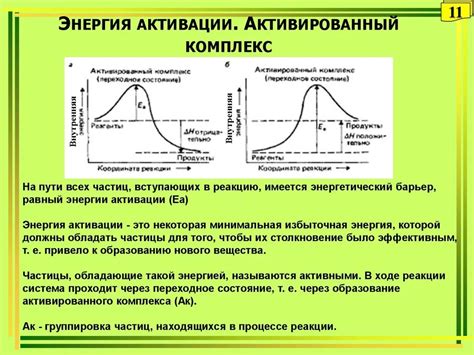
В химических реакциях энергия активации играет важную роль, определяя скорость и возможность протекания реакции. Энергия активации (Ea) представляет собой минимальную энергию, которую реакция должна получить для преодоления активационного барьера и начала процесса реакции.
Энергия активации зависит от типа взаимодействующих частиц, а также от условий среды. В реакциях, где взаимодействие между частицами происходит легко, энергия активации будет низкой, и реакция протекает быстро. В случае, когда необходимо преодолеть сильные притяжения или разрушить химические связи, энергия активации будет высокой, и реакция будет протекать медленно или вовсе не будет возможна.
Энергия активации можно снизить путем использования катализаторов. Катализаторы ускоряют химические реакции, снижая энергию активации, но при этом сами не участвуют в реакции и остаются неизменными после ее завершения. Катализаторы обычно обладают поверхностью, на которой происходят реакции, и способны сформировать промежуточные комплексы с реагентами, ускоряя их превращение в продукты.
Важно отметить, что химические реакции могут протекать при комнатной температуре, но процесс может быть слишком медленным и неэффективным. Повышение температуры обычно увеличивает скорость реакции, поскольку подавляет энергию активации. Также можно использовать давление и концентрацию реагентов, чтобы изменить энергию активации и скорость реакции.
Влияние окружающей среды на электрохимический ряд

Электрохимический ряд напряжений металлов позволяет установить их относительные степени активности в химических реакциях. Однако, влияние окружающей среды может изменить порядок расположения металлов в ряду.
В первую очередь, окружающая среда может вызвать коррозию металлов. В результате коррозии, некоторые металлы могут образовывать пассивные пленки, которые защищают их от дальнейшего разрушения. Например, алюминий, который находится ниже железа в электрохимическом ряду, образует плотную оксидную пленку на своей поверхности, что предотвращает дальнейшую коррозию.
Кроме того, окружающая среда может влиять на электродные потенциалы металлов и их реакции с растворенными веществами. Например, в кислых условиях, некоторые металлы, такие как цинк и алюминий, проявляют высокую активность, в то время как неделимые металлы, например, золото и платина, остаются пассивными.
Окружающая среда может также изменить порядок металлов в электрохимическом ряду через взаимодействия с различными растворами и элементами. Например, водородное перекисное кислотное растворение алюминия приводит к его выделению в виде газа, что позволяет алюминию стать активнее, чем железо в данной окружающей среде.
Таким образом, окружающая среда может существенно влиять на электрохимический ряд, меняя активность и реакционную способность различных металлов. Это важно учитывать при выборе материалов для конкретных условий эксплуатации.
Практическое применение электрохимического ряда

Электрохимический ряд напряжений металлов является важным инструментом в химии и электрохимии. Он указывает на относительную активность различных металлов и их способность к окислительно-восстановительным реакциям. Это позволяет предсказывать, какие пары металлов будут давать электрохимическую реакцию и какой будет направление потока электронов в различных условиях.
Электрохимический ряд имеет множество практических применений. Он используется для выбора эффективных анодов и катодов в различных электролизных процессах. Например, если требуется извлечь металл из его раствора, можно использовать металл с более низким потенциалом окисления в качестве анода, чтобы он окислился, а металл с более высоким потенциалом восстановления в качестве катода, чтобы он осаждался на поверхности. Это также применяется в батареях, аккумуляторах и топливных элементах, где происходят электрохимические реакции для генерации электричества.
Электрохимический ряд также используется для проведения коррозионных исследований. Он позволяет определить, какие металлы будут предпочтительно корродировать в различных средах, что важно при разработке защитных покрытий и материалов, предотвращающих коррозию. Благодаря электрохимическому ряду можно определить, какая пара металлов образует электрохимическую гальваническую пару, что используется для защиты от коррозии путем предоставления "жертвенного анода", который будет предпочтительно корродировать вместо защищаемого металла.
Кроме того, электрохимический ряд является основой для определения электродных потенциалов различных металлов и проницаемости ионов через мембраны. Это также используется для расчета электродных потенциалов и электродного потенциала обратной реакции. Все это является важным для понимания и контроля различных электрохимических процессов в разных областях науки и техники.
Проблемы с использованием металлов

Использование металлов в различных отраслях промышленности и повседневной жизни нередко сталкивается с определенными проблемами. Одной из основных проблем является коррозия металлов. Коррозия – это процесс химического разрушения металлов под действием окружающей среды. Коррозия может негативно сказаться на качестве и долговечности металлических изделий, особенно в условиях повышенной влажности или агрессивных химических средах.
Другой проблемой при использовании металлов является их токсичность. Некоторые металлы, такие как свинец, ртуть или кадмий, могут иметь ядовитое воздействие на организм человека или животных. Попадая в природу, эти металлы могут загрязнять почву, воду и воздух, вызывая экологические проблемы и угрожая здоровью людей и экосистемам в целом.
Еще одной проблемой, связанной с использованием металлов, является их ограниченный запас в природе. Некоторые металлы, такие как кобальт или редкоземельные элементы, являются дефицитными и ограниченными ресурсами. Их добыча и использование могут привести к деградации природных экосистем и конфликтам из-за соперничества за доступ к этим ресурсам.
Для решения этих проблем необходимо разрабатывать и применять новые технологии и материалы, которые были бы менее подвержены коррозии, менее токсичными или основаны на более доступных и экологически устойчивых ресурсах. Это поможет обеспечить устойчивое использование металлов и снизить их негативное воздействие на окружающую среду и здоровье людей. Также важно вести более ответственную политику в отношении переработки и утилизации металлических отходов, чтобы минимизировать их негативное воздействие.
Выводы

Изучение электрохимического ряда напряжений металлов позволяет сделать следующие выводы:
- Металлы, находящиеся ниже в ряду, обладают большей реакционной активностью по сравнению с металлами, находящимися выше.
- В реакциях окисления металлов токсичные и коррозионно-активные свойства проявляются у металлов, находящихся ближе к началу ряда, в то время как металлы, находящиеся ближе к концу ряда, обладают более благородными, коррозионно-устойчивыми свойствами.
- Металлы ниже в ряду смогут вытеснить металлы, находящиеся выше в ряду, из раствора своих солей.
- Чем больше разность напряжений (потенциалов) между двумя металлами в ряду, тем выше вероятность их электрохимической реакции и тем более интенсивная она будет.
Электрохимический ряд напряжений металлов имеет практическое применение при выборе материалов для коррозионно-устойчивых конструкций, при проведении гальванической защиты, при оценке возможности возникновения гальванической коррозии и в других областях, связанных с электрохимическими реакциями металлов.
Вопрос-ответ

Что такое электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов - это упорядоченный список металлов по их способности отдавать или принимать электроны во время химических реакций. В этом ряду металлы расположены в порядке убывания их окислительной активности, где более активные металлы находятся в верхней части ряда, а менее активные - в нижней. Ряд служит основой для прогнозирования направленности электрохимических реакций.
Какие факторы влияют на положение металла в электрохимическом ряду напряжений?
Положение металла в электрохимическом ряду напряжений зависит от некоторых факторов, включая электроотрицательность, размер атома и заряд ядра. По общему правилу, чем выше в ряду находится металл, тем больше его склонность отдавать электроны и тем больше его окислительный потенциал.
Какие металлы являются самыми активными по электрохимическому ряду напряжений?
Самыми активными металлами в электрохимическом ряду напряжений являются щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие. Они обладают высокой склонностью отдавать электроны и имеют большой окислительный потенциал.
