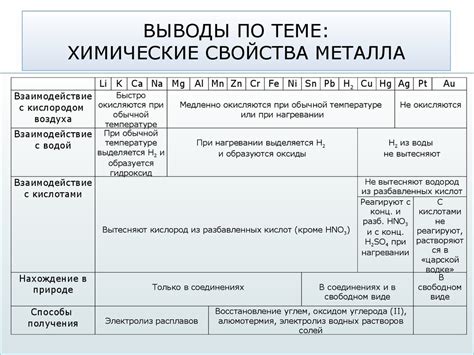
Металлы – это важная группа химических элементов, которая включает в себя большое количество различных веществ. Металлы обладают рядом уникальных химических свойств, которые отличают их от других элементов. В химии металлы часто описывают как элементы, способные образовывать положительные ионы. Это связано с тем, что в атомах металлов обычно превалируют электроны, которые легко могут уйти от атомов, образуя ионы с положительным зарядом.
Одним из основных химических свойств металлов является их способность к реакции с кислородом. Многие металлы могут образовывать оксиды при взаимодействии с кислородом из воздуха или воды. Например, железо ржавеет при взаимодействии с кислородом из воздуха, образуя оксид железа. Также способность металлов реагировать с кислородом позволяет им образовывать многочисленные оксиды, которые могут быть использованы в различных областях, от производства стекла до производства промышленных катализаторов.
Ещё одним важным химическим свойством металлов является их способность образовывать сплавы. Сплавы - это смеси двух или более металлов. Образование сплавов позволяет металлам приобретать новые свойства и характеристики. Например, добавление небольшого количества другого металла может сделать сплав более прочным, устойчивым к коррозии или обладающим специальными электрическими свойствами.
Таким образом, основные химические свойства металлов включают способность образовывать положительные ионы, реагировать с кислородом и образовывать сплавы. Эти свойства делают металлы незаменимыми материалами в современном обществе и широко используются во многих отраслях промышленности и научных исследованиях.
Химические свойства металлов: реакции с кислородом
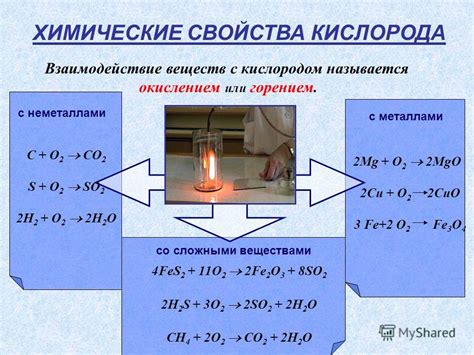
Металлы активно взаимодействуют с кислородом, образуя оксиды. Это свойство является одной из основных характеристик металлов и обуславливает их способность гореть. Реакция с кислородом может происходить как при нагревании металла, так и при его контакте с кислородом при обычных условиях.
В результате реакции с кислородом образуется оксид металла, который обычно представляет собой твёрдое вещество с определёнными свойствами. Оксиды металлов могут быть разной степени окисления, что влияет на их цвет, плотность, растворимость в воде и другие свойства.
Некоторые металлы, такие как алюминий, магний и цинк, вступают в реакцию с кислородом только при нагревании до высокой температуры. Другие металлы, например, натрий и калий, реагируют с кислородом уже при обычных условиях без нагревания.
Однако не все металлы активно взаимодействуют с кислородом. Некоторые металлы, например, золото и платина, являются химически инертными и не реагируют с кислородом без использования специальных условий.
Учимся определять активность металлов

Активность металлов - это способность металлов реагировать с кислотами. Чем больше активность металла, тем легче он реагирует с кислотами и выделяет молекулы водорода.
Определение активности металлов проводится путем наблюдения за их реакцией с кислотами. Для этого взяты образцы различных металлов и помещены в растворы разных кислот. При взаимодействии с кислотой активные металлы выделяют пузырьки газа - это молекулы водорода.
Для определения активности металлов существует ряд экспериментов. Один из них - эксперимент с соляной кислотой. В этом опыте образцы металлов помещают всплавленный буфер раствором соляной кислоты. Наблюдение за выделением газа и его интенсивностью позволяет определить активность данного металла.
На основе результатов опытов была составлена таблица активности металлов. Она позволяет классифицировать металлы по их активности. Например, в таблице наиболее активными металлами являются щелочные и щелочноземельные металлы, такие как натрий, калий, магний. В то время как серебро и золото являются малоактивными металлами.
Таким образом, определение активности металлов позволяет нам классифицировать их по способности взаимодействовать с кислотами. Знание активности металлов необходимо для предсказания и понимания их химических свойств и реакций.
Химические свойства металлов: реакция с кислотами
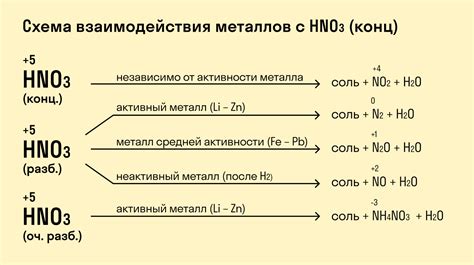
Металлы обладают особыми химическими свойствами, которые проявляются в их взаимодействии с различными веществами. Реакция металлов с кислотами является одним из ключевых проявлений этих свойств.
При взаимодействии металлов с кислотами происходит химическая реакция, в результате которой образуются соли и выделяется водород. Эта реакция называется металлическим нагреванием кислоты.
В качестве реакционного компонента металлы могут использовать различные кислоты, такие как соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3) и другие. Реакция металла с кислотой происходит с выделением пузырьков газа и образованием соли.
Так, например, при реакции цинка (Zn) с соляной кислотой образуется хлорид цинка (ZnCl2) и выделяется молекулярный водород по реакции:
Zn + 2HCl = ZnCl2 + H2
Такие реакции с кислотами характерны для большинства металлов и могут быть использованы при получении солей и водорода в лабораторных условиях.
Изучение реакции металлов с кислотами имеет практическое значение и выполняется в химической лаборатории, а также используется при изготовлении различных продуктов, таких как пищевые добавки или металлопокрытия.
Урок по реакции металлов с соляной кислотой

Соляная кислота (хлороводородная кислота) - одна из самых известных и широко используемых кислот. Она является сильным оксидирующим агентом и обладает высокой агрессивностью. На уроке мы изучим реакцию металлов с соляной кислотой и рассмотрим ее основные химические свойства.
Реакция металлов с соляной кислотой является типичным случаем обменной реакции. При взаимодействии металла с соляной кислотой образуется соль и водород. Во время реакции наблюдается выделение пузырьков газа и образование характерного шипящего звука.
Многие металлы могут реагировать с соляной кислотой, но скорость реакции и интенсивность выделения газа зависят от свойств каждого конкретного металла. Наиболее активными металлами являются щелочные, щелочноземельные и некоторые переходные металлы.
При реакции наблюдается ощутимое повышение температуры, что связано с химической реакцией. Каждый металл имеет свою особенность взаимодействия с соляной кислотой, и поэтому урок посвящен изучению реакции разных металлов, их химических свойств и результатов взаимодействия с кислотой.
В конце урока стоит провести обобщение и систематизацию полученных знаний. Это можно сделать при помощи таблицы, в которой будут указаны реакционные способности различных металлов и их соляных соединений. Такой подход поможет закрепить полученные знания и систематизировать информацию об основных химических свойствах металлов.
Важность учета активности металлов при их реакции с кислотами
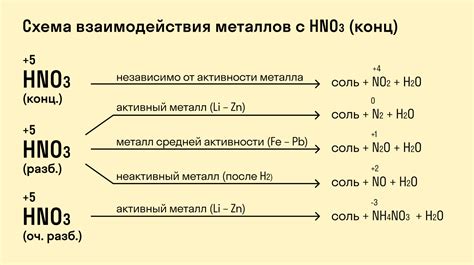
Активность металлов – важная характеристика, которую необходимо учитывать при изучении их реакции с кислотами. Активность металлов определяется их способностью образовывать ион М+, вытеснять другие металлы из растворов и образовывать соединения с кислородом.
Реакция металлов с кислотами основана на протекании окислительно-восстановительной реакции, при которой металл отдает электроны, а кислота получает их. Активность металлов определяет скорость протекания данной реакции, а также возможность образования высокоактивных соединений.
Правила активности металлов позволяют определить, какой металл способен вытеснить другой из его соли при реакции с кислотой. Например, активные металлы, такие как калий или натрий, способны вытеснить менее активные металлы, например, железо или медь, из их солей и образовывать новые соединения.
Учет активности металлов при их реакции с кислотами позволяет предсказать результаты химических реакций, а также понять, какие металлы могут быть использованы в различных процессах и технологиях. Например, активные металлы часто используются в производстве батареек и аккумуляторов, так как они обладают высокой электрохимической активностью.
Химические свойства металлов: реакция с водой
Металлы обладают различными химическими свойствами, одним из которых является их реакция с водой. Некоторые металлы реагируют с водой, образуя гидроксиды и выделяя водород.
Один из наиболее известных примеров такой реакции - реакция натрия с водой. При погружении металла в воду происходит интенсивное выделение пузырьков водорода, и образуется щелочь - гидроксид натрия. Подобным образом реагируют литий, калий и другие щелочные металлы.
Некоторые металлы реагируют с водой при нагревании. Например, магний и цинк выделяются из воды в виде гидроксидов при нагревании жидкости. Эти металлы также обладают свойством реагировать с паром воды.
Однако не все металлы взаимодействуют с водой. Серебро, золото и платина не проявляют активности при контакте с водой. Эти металлы являются химически инертными и не реагируют с большинством веществ.
Таблица Менделеева позволяет легко определить, какие металлы реагируют с водой и какие нет. В столбце активных металлов (группа 1 и 2) периодической системы Mendeleev можно найти металлы, которые активно взаимодействуют с водой. Неактивные металлы располагаются в остальных столбцах и не образуют реакций с водой.
Демонстрация реакции металлов с водой

Металлы обладают различными свойствами, включая их реакцию с водой. Демонстрация этой реакции позволяет ученикам наглядно увидеть, какие металлы реагируют с водой и как именно это происходит.
Во время демонстрации реакции с водой можно использовать различные металлы, такие как натрий, калий или магний. Известно, что натрий и калий реагируют с водой достаточно интенсивно, выделяясь пламенем и характерными звуками, в то время как магний реагирует более медленно.
Для проведения демонстрации можно использовать небольшие кусочки металлов, которые опускаются в стеклянную колбу или пробирку с водой. После того как металл контактирует с водой, можно наблюдать выделение пузырьков газа и возгорание пламени при реакции натрия или калия.
В процессе демонстрации важно подчеркнуть, что реакция с водой происходит из-за активности металлического элемента, который старается извлечь кислород из молекулы воды. Результатом этой реакции является образование гидроксидов металлов и выделение водорода.
Демонстрация реакции металлов с водой не только помогает ученикам лучше понять основные химические свойства металлов, но также развивает навыки наблюдения и анализа реакций. Этот урок помогает ученикам взаимодействовать со своим окружением с помощью химических экспериментов и дает им возможность увидеть, как знания химии применяются на практике.
Химические свойства металлов: способы защиты от окисления
Металлы обладают высокой химической активностью и способны реагировать с окружающей средой. Одной из основных проблем, с которыми сталкиваются металлы, является окисление, т.е. взаимодействие с кислородом воздуха. Окисление металлов приводит к образованию оксидов, которые способны разрушать металлическую структуру, вызывать коррозию и потерю свойств.
Существует несколько способов защиты металлов от окисления:
- Покрытия. Один из основных способов защиты металлов - нанесение на их поверхность различных покрытий. Такие покрытия могут быть органическими или неорганическими. Они образуют защитную пленку, которая препятствует взаимодействию металла с окружающей средой.
- Гальваническая защита. Включает в себя создание электрической цепи с помощью различных металлов. При этом, более реактивный металл служит анодом, а менее реактивный - катодом. Это позволяет достичь электрохимической защиты металла от окисления.
- Пассивация. Некоторые металлы образуют на своей поверхности пассивную оксидную пленку, которая защищает металл от окисления. Например, нержавеющая сталь образует пассивную пленку из оксида хрома, которая предотвращает коррозию металла.
Использование этих методов защиты позволяет сохранить металлические изделия в исходном состоянии, продлить их эксплуатационный срок и обеспечить надежность и безопасность конструкций, которые используют металлы.
Вопрос-ответ

Зачем нужно изучать основные химические свойства металлов?
Изучение основных химических свойств металлов позволяет понять, как они взаимодействуют с другими веществами. Это важно для понимания процессов, происходящих в природе и в промышленности, а также для разработки новых материалов и технологий.
