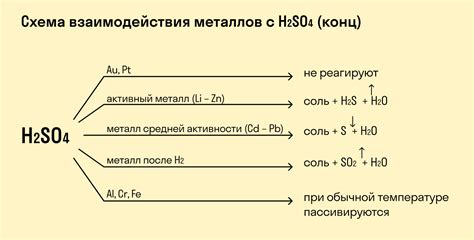
Хлор является одним из самых активных химических элементов и обладает сильно окислительными свойствами. Он способен реагировать с различными металлами и образовывать соединения, которые могут иметь как положительные, так и отрицательные электрические заряды.
Реакция хлора с металлами обычно протекает с выделением тепла и света, что делает ее заметной и зрелищной. Чаще всего это происходит при нагревании или взаимодействии хлора с металлической пульверизацией.
Уравнения химических реакций хлора с металлами выглядят следующим образом:
Металл + Хлор → Металлическая хлоридная соль
Например, реакция хлора с натрием протекает следующим образом:
2Na + Cl2 → 2NaCl
Подобные реакции важны не только с точки зрения химической теории, но также имеют практическое применение. Металлические хлоридные соли находят широкое применение в различных отраслях промышленности и научных исследованиях.
Взаимодействие хлора с щелочными металлами
Хлор является одним из самых распространенных элементов в природе и хорошо известен своими химическими свойствами. Хлор обладает высокой реактивностью и может вступать в реакции с различными веществами, включая металлы. В частности, хлор может взаимодействовать с щелочными металлами, такими как натрий, калий и литий.
В результате взаимодействия хлора с щелочными металлами образуются хлориды этих металлов. Например, реакция между натрием и хлором приводит к образованию натрия хлорида (NaCl). Эта реакция происходит с выделением большого количества тепла и сопровождается яркими вспышками света.
Реакция хлора с щелочными металлами может быть описана следующим уравнением:
2Na + Cl2 → 2NaCl
Взаимодействие хлора с калием и литием происходит по аналогичному принципу. Образующиеся при этом хлориды, такие как KCl и LiCl, обладают схожими свойствами и широко используются в различных областях промышленности, включая химическую промышленность и производство лекарственных препаратов.
Вывод: взаимодействие хлора с щелочными металлами приводит к образованию хлоридов этих металлов. Это реакции с высокой энергией, которые могут быть полезными для различных промышленных процессов.
Хлор и реакция с щелочно-земельными металлами
Хлор - это высокоэффективный химический элемент, который проявляет широкий спектр взаимодействий с другими веществами. В частности, он реагирует с щелочно-земельными металлами, такими как магний, кальций, барий и стронций.
Когда хлор вступает в реакцию с щелочно-земельными металлами, образуется хлорид металла. Эта реакция происходит при высоких температурах и является экзотермической, то есть сопровождается выделением тепла.
Наиболее распространенной реакцией хлора с щелочно-земельными металлами является образование хлорида магния (MgCl2). Этот химический соединение обладает высокой растворимостью в воде и широко используется в промышленности и лаборатории.
Хлор и щелочно-земельные металлы также могут образовывать другие хлориды, такие как кальция (CaCl2), бария (BaCl2) и стронция (SrCl2). Все эти соединения легко растворимы в воде и находят применение в различных отраслях промышленности и химической лаборатории.
В заключение можно сказать, что реакция хлора с щелочно-земельными металлами играет важную роль в химии и промышленности. Образование хлоридов этих металлов является одним из множества способов использования хлора и его соединений.
Хлор и взаимодействие с металлами побочных подгрупп

Хлор является одним из самых активных химических элементов, и его взаимодействие с металлами побочных подгрупп не является исключением. Металлы побочных подгрупп – это элементы, относящиеся к группе «П» и «Б» периодической системы, и они обладают различными химическими свойствами.
Хлор может реагировать со многими металлами побочных подгрупп, образуя хлориды. Хлориды металлов побочных подгрупп обычно имеют высокую температуру плавления и кипения и обладают хорошей растворимостью в воде. Некоторые хлориды, такие как хлорид железа (III) и хлорид алюминия, являются важными катализаторами в различных химических процессах.
Взаимодействие хлора с металлами побочных подгрупп может протекать различными способами. Например, хлор может образовывать ковалентные связи с металлами, образуя хлоридные комплексы. Кроме того, хлор может также получать электроны от металлов побочных подгрупп, образуя ионные хлориды.
Взаимодействие хлора с металлами побочных подгрупп может иметь разные последствия. Например, при взаимодействии с алюминием хлор может привести к образованию алюминиевого хлорида, который является основным компонентом промышленной производства алюминия. Некоторые хлориды металлов побочных подгрупп могут также использоваться в производстве различных химических продуктов, таких как пластмассы, лекарственные препараты и красители.
Создание хлоридов металлов при реакции с металлами переходных подгрупп

Хлор является одним из самых широко используемых элементов в химии и обладает высокой реакционной способностью. Реакция хлора с металлами переходных подгрупп приводит к образованию хлоридов металлов.
Металлы переходных подгрупп, такие как железо (Fe), медь (Cu), никель (Ni) и цинк (Zn), обладают различными свойствами и способностью реагировать с хлором. Реакция металлов с хлором происходит при высоких температурах и обеспечивает образование хлорида металла.
Процесс реакции часто сопровождается выделением тепла и света. Например, реакция меди с хлором приводит к образованию хлорида меди (CuCl2) и сопровождается ярким зеленоватым пламенем.
Хлориды металлов находят широкое применение в различных областях. Например, хлорид железа (FeCl2 и FeCl3) используется в производстве железных сплавов и катализаторов. Хлорид никеля (NiCl2) применяется в процессе электропокрытия и производстве никелевых сплавов.
Таким образом, реакция хлора с металлами переходных подгрупп приводит к образованию хлоридов металлов, которые имеют широкий спектр применения в различных отраслях промышленности и науки.
Процессы хлорирования металлов и их сплавов

Хлорирование металлов является важным процессом в химической промышленности. Это метод, который позволяет изменять физические и химические свойства металлов, добавляя к ним атомы хлора. Хлорирование применяется для получения сплавов с повышенной прочностью, коррозионной стойкостью или другими специальными свойствами.
Процесс хлорирования металлов может производиться различными способами. Например, можно использовать газовую фазу, в которой металл нагревается до высокой температуры и взаимодействует с хлором. Этот процесс обычно проводится в специальных печах или реакторах, где создаются оптимальные условия для химических реакций.
Также существует метод хлорирования в жидкой фазе, при котором хлор добавляется к металлическому расплаву. Этот способ позволяет более точно контролировать процесс и получить сплавы с заданными характеристиками. Хлорирование в жидкой фазе широко применяется в производстве сплавов на основе цинка, алюминия и других металлов.
Процессы хлорирования металлов и их сплавов требуют точного контроля параметров, таких как температура, концентрация хлора и время воздействия. Это позволяет добиться нужных свойств материала и улучшить его характеристики. Однако следует отметить, что хлорирование может быть опасным процессом, требующим соблюдения всех мер предосторожности и специальных условий безопасности.
Выводя самые важные аспекты, можно сказать, что процессы хлорирования металлов и их сплавов являются важным шагом в производстве материалов с желаемыми свойствами. Он позволяет изменять физические и химические характеристики металла, делая его подходящим для конкретных применений в различных отраслях промышленности.
Вопрос-ответ

Какие металлы реагируют с хлором?
С хлором реагируют металлы из I и II групп периодической системы, такие как натрий, калий, магний, цезий и др.
Какие вещества образуются при реакции хлора с металлами?
При реакции хлора с металлами, образуются хлориды, например, хлорид натрия (NaCl), хлорид калия (KCl) и т.д.
Что происходит с металлом при реакции с хлором?
При реакции с хлором, металл окисляется, т.е. теряет электроны, становясь положительным ионом, атом хлора в свою очередь получает электроны, становясь отрицательным ионом.
Каким образом можно предсказать реакцию хлора с металлами?
Для предсказания реакции хлора с металлами, можно использовать активность металлов в ряду активности. Если металл находится выше хлора в ряду активности, значит он сможет вытеснить хлор из своего соединения и произойдет реакция.
