Металлы являются одним из основных классов химических элементов и обладают уникальными химическими свойствами. Они могут образовывать растворы, подвергаться окислению и восстановлению, а также образовывать соединения с не-металлами. Уравнения химических реакций позволяют описать эти процессы и представить их в виде химических формул и символов.
Окисление и восстановление являются ключевыми процессами в химии металлов. Во время окисления металл теряет электроны и образует положительные ионы, в то время как восстановление происходит при передаче электронов от одного вещества к другому. Уравнения химических реакций позволяют описать эти процессы с помощью соответствующих символов и коэффициентов.
Металлы также могут образовывать растворы с водой или кислотами. В результате такой реакции металл может раствориться, образуя положительные ионы и выделяя водород. Уравнения химических реакций позволяют описать взаимодействие металла с водой или кислотами и представить его в виде формул и символов.
Важность химических свойств металлов
Металлы обладают множеством химических свойств, которые играют важную роль во многих областях нашей жизни. Они используются в промышленности, в медицине, в строительстве, в электронике и многих других сферах. Знание и понимание химических свойств металлов является ключевым при разработке новых материалов и технологий.
Одно из главных химических свойств металлов - их способность вступать в реакции с другими веществами. Металлы могут образовывать ионы, обладающие положительным зарядом, и часто вступают в обменные реакции с отрицательно заряженными анионами. Это позволяет им образовывать соединения с различными элементами и обладать разнообразными физическими и химическими свойствами.
Например, железо, один из наиболее распространенных металлов, образует соединения с кислородом, в результате чего образуется ржавчина. Это химическое свойство железа играет важную роль в процессе коррозии, которая может привести к разрушению и повреждению металлических конструкций.
Химические свойства металлов также влияют на их способность проводить электричество и тепло. Многие металлы обладают высокой электропроводностью, что делает их основными материалами для проводов и электрических контактов. Они также обладают высокой теплопроводностью, что позволяет им эффективно передавать тепло. Эти свойства используются в различных технологических процессах и в производстве различных устройств.
Важность химических свойств металлов также проявляется в их способности образовывать сплавы. Сплавы - это смеси двух или более металлов, которые обладают новыми свойствами. Сплавы могут быть более прочными, устойчивыми к коррозии, иметь более низкую плотность или другие полезные свойства, которые делают их идеальными для определенных применений.
В целом, понимание и использование химических свойств металлов является ключевым для создания новых материалов и технологий, повышения эффективности процессов и улучшения качества продукции в различных отраслях науки и промышленности.
Металлы в химических реакциях

Металлы являются активными элементами, которые способны участвовать в разнообразных химических реакциях. Они обладают высокой реакционной способностью и часто действуют как доноры электронов, образуя положительные ионы.
Одной из типичных реакций металлов является их взаимодействие с кислотами. В результате такой реакции металл может вытеснить водород из кислоты, образуя соли. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода.
Металлы также могут вступать в реакцию с кислородом, образуя оксиды, которые являются основами многих минералов и растительных подкормок. Реакция алюминия с кислородом приводит к образованию алюминиевого оксида, который широко используется в промышленности и строительстве.
Еще одной характерной особенностью металлов в химических реакциях является их способность к редокс-реакциям, то есть реакциям окисления и восстановления. Металлы могут быть окислены взаимодействием с окислителем, например, кислородом, некоторыми химическими соединениями или даже другими металлами. В результате таких реакций металл образует положительный ион, а окислитель получает нужное количество электронов.
Кроме того, металлы могут взаимодействовать с неметаллами, образуя бинарные соединения. Например, реакция натрия с хлором приводит к образованию хлорида натрия, который широко используется в пищевой промышленности и в бытовых целях. Такие реакции позволяют получать различные соединения, которые имеют важное значение в жизни человека и промышленности.
Металлы как катализаторы химических процессов

Металлы являются важными катализаторами в многих химических процессах. Катализаторы - это вещества, которые ускоряют химические реакции, повышая скорость реакции, но остаются неизменными после прохождения реакции.
Катализаторы существенно снижают активационную энергию реакции, что делает процесс более эффективным. Металлы обладают специфическими свойствами и взаимодействуют с молекулами реагентов, формируя комплексы и активные центры реакций.
Одной из основных ролей металлов в каталитических реакциях является их способность принимать и отдавать электроны. Электронные переносы, происходящие на поверхности металла, позволяют активировать реагенты и образовать промежуточные состояния, участвующие в реакции.
Металлические катализаторы могут использоваться в различных областях химии, включая органическую, неорганическую и физическую химию. Они находят применение, например, в процессах синтеза органических соединений, водородации, окислений и гидрирований.
Катализаторы на основе металлов обладают высокой активностью и селективностью, что позволяет контролировать химические реакции и получать целевые продукты с высокой степенью чистоты. Благодаря использованию металлических катализаторов в химической промышленности достигается экономия энергии и ресурсов.
Коррозия металлов и их реакция с кислородом

Металлы, будучи в природе нетруднодоступными элементами, подвержены воздействию окружающей среды. Особенно активно они взаимодействуют с кислородом, который становится причиной коррозии металлов.
Коррозия – это процесс разрушения металлических материалов под воздействием окружающей среды, приводящий к образованию окислов, гидрооксидов и солей металлов. Основной причиной коррозии является реакция металла с кислородом влажного воздуха.
Когда металл вступает в реакцию с кислородом, образуется оксид металла (окись). Некоторые металлы обладают сильной способностью к окислению и поэтому быстро подвергаются коррозии. Например, железо, под воздействием кислорода и влаги, окисляется, образуя ржавчину – гидрооксид железа.
Однако не все металлы разрушаются под воздействием кислорода. Например, алюминий покрывается оксидной пленкой, которая защищает металл от дальнейшей коррозии. Также некоторые металлы, такие как золото, платина и серебро, практически не взаимодействуют с кислородом и не подвержены коррозии.
Для защиты металлов от коррозии используют различные методы, например, нанесение защитных покрытий, антикоррозионных покрытий или использование коррозионностойких металлов. Это позволяет увеличить срок службы металлических изделий и обеспечить их долговечность.
Окисление и восстановление металлов
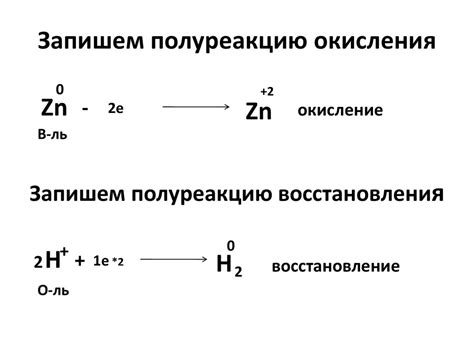
Окисление и восстановление металлов – это процессы, связанные с передачей электронов между металлическими атомами и атомами других веществ. Они происходят при химических реакциях и играют важную роль в различных областях науки и промышленности.
Процесс окисления металлов заключается в передаче электронов от металлических атомов к атомам других веществ, например, кислорода или воды. При окислении металл может образовывать ионы, имеющие положительный заряд, так называемые катионы. Окисление может приводить к образованию оксидов, гидроксидов или других соединений.
С другой стороны, восстановление металлов представляет собой противоположный процесс, при котором металл получает электроны от атомов других веществ. В результате восстановления металл может образовывать ионы с отрицательным зарядом, так называемые анионы. Восстановление широко используется в электрохимии и электролизе, а также при производстве легированных металлов.
Окисление и восстановление металлов играют ключевую роль в электрохимических реакциях, таких как гальванические элементы и аккумуляторы. Кроме того, эти процессы важны для понимания реакций, происходящих в атмосфере, при коррозии металлов и во многих других химических процессах.
Реакция металлов с кислотами и основаниями

Металлы – это химические элементы, которые обладают свойствами реагировать с кислотами и основаниями. Результаты таких реакций могут быть различными в зависимости от металла и реагента, с которым он взаимодействует.
Когда металл реагирует с кислотой, образуется соль и выделяется водород. Например, реакция металла железа Fe с соляной кислотой HCl приводит к образованию хлорида железа FeCl2 и выделению водорода H2:
2 Fe + 6 HCl → 2 FeCl2 + 3 H2
Реакция металлов с основаниями также приводит к образованию соли, но вместо выделения водорода осуществляется выделение гидроксида металла. Например, реакция металла натрия Na с гидроксидом натрия NaOH приводит к образованию поваренной соли NaCl и выделению гидроксида натрия NaOH:
2 Na + 2 NaOH → 2 NaCl + 2 H2O
В результате этих реакций металлы проявляют свою активность и способность активно взаимодействовать с другими веществами. Такие реакции имеют практическое применение в различных отраслях промышленности, а также являются основой для получения солей и других химических соединений.
Реакция металлов с солями

Металлы обладают различными химическими свойствами, в том числе способностью реагировать с различными соединениями, такими как соли. Реакция металлов с солями характеризуется обменом ионов, что приводит к образованию новых веществ и сопровождается изменением цвета, возникновением осадка или выделением газов.
В химии широко изучены реакции металлов с солями кислот. Например, при взаимодействии цинка с соляной кислотой образуется хлорид цинка и выделяется водородный газ:
Zn + 2HCl → ZnCl2 + H2
Подобные реакции наблюдаются и с другими металлами, такими как железо, медь, свинец и др. Часто в результате реакции металлов с солями образуются осадки в виде солей металлов, которые могут быть описаны уравнениями, например:
Fe + CuSO4 → FeSO4 + Cu
Металлы с различной активностью проявляют разную реакционную способность. Некоторые металлы, такие как калий или натрий, могут реагировать с солями даже при комнатной температуре, в то время как другие металлы, например серебро или золото, сильно инертны и менее подвержены реакциям.
Действие металлов в электролитических реакциях

Металлы могут проявлять активность при взаимодействии с различными веществами, включая электролиты. В электролитических реакциях металл может выступать в качестве активного агента, являясь источником электронов или принимая их от окружающих частиц.
Когда металл погружают в раствор электролита, его поверхность начинает реагировать с раствором. При этом происходят окислительно-восстановительные реакции, которые могут привести к различным химическим изменениям.
В электролитических реакциях, происходящих на поверхности металла, обычно один из продуктов реакции выпадает в виде осадка или растворяется в растворе. Кроме того, металл может выделяться на поверхности или растворяться из нее, что также влияет на процесс электролитической реакции.
Величина электрического тока, проходящего через металл, может быть использована для определения его активности в электролитической реакции. Чем больше ток проходит через металл, тем более активным он является в данной реакции. Кроме того, при изучении электролитических реакций металлов учитываются такие факторы, как концентрация реагентов, температура, растворимость и другие параметры системы.
Уравнения электролитических реакций с участием металлов включают в себя указание вещества, переходящего в раствор или выпадающего в осадок, а также указание металла и его оксидационного состояния в начальной и конечной точках реакции.
Интересные примеры электролитических реакций металлов включают растворение цинка в серной кислоте, покрытие предметов медью при электролизе раствора медного купороса и окисление алюминия в воде в результате гальванической реакции.
Воздействие металлов на биологические процессы

Металлы играют важную роль в биологии и оказывают влияние на множество биологических процессов в организме. Они являются необходимыми микроэлементами для нормального функционирования клеток.
Один из самых важных металлов для организма - железо. Оно входит в состав гемоглобина, кислородно-связывающего белка в крови. Железо также участвует в реакциях окислительно-восстановительных процессов в организме.
Кальций - еще один важный металл, необходимый для формирования и поддержания костной ткани, а также для нормального функционирования нервной системы и мышц.
Магний играет роль кофактора во многих ферментативных реакциях в клетке, в том числе, в синтезе ДНК и РНК. Он также участвует в поддержании электрохимического баланса в клетке и регулировании активности ионных каналов.
Однако, металлы также могут иметь токсичное воздействие на организм. Некоторые металлы, такие как свинец и кадмий, могут накапливаться в тканях и оказывать прямое воздействие на ферменты и белки, нарушая их функции.
Поэтому важно поддерживать баланс между поступлением и выводом металлов из организма. Регулярное потребление продуктов, богатых металлами, и соблюдение правил гигиены помогут поддержать нормальное функционирование биологических процессов, связанных с металлами.
Таблица 1: Влияние металлов на биологические процессы:
| Металл | Роль в организме | Влияние на биологические процессы |
|---|---|---|
| Железо | Формирование гемоглобина Участие в окислительно-восстановительных реакциях | Нехватка железа может привести к анемии |
| Кальций | Формирование и поддержание костной ткани Нормальное функционирование нервной системы и мышц | Нехватка кальция может привести к остеопорозу |
| Магний | Участие в ферментативных реакциях Регулирование активности ионных каналов | Нехватка магния может привести к судорогам и нарушениям нервной системы |
Вопрос-ответ

Какие химические реакции могут происходить с металлами?
С металлами могут происходить различные химические реакции, такие как окисление, восстановление, образование солей и многое другое. Конкретная реакция зависит от химических свойств конкретного металла и условий реакции.
Как происходит окисление металлов?
Окисление металлов происходит при взаимодействии металла с кислородом. В результате окисления металл теряет электроны и образует положительные ионы металла. Важно отметить, что разные металлы окисляются с разной скоростью и образуют разные оксиды.
Что происходит при взаимодействии металла с кислотой?
При взаимодействии металла с кислотой происходит реакция, в результате которой образуется соль и выделяется водород. Металл замещает водород в кислоте, и происходит образование ионов металла и ионов водорода.
Как происходит реакция металла с неметаллом?
Реакция металла с неметаллом приводит к образованию химического соединения, которое называется солью. В таких реакциях металл отдает электроны, становится положительным ионом, а неметалл принимает электроны и становится отрицательным ионом.
