Уравнения водорода с щелочными металлами представляют собой особый класс химических реакций, где водород вступает во взаимодействие с металлами первой группы периодической системы: литием, натрием, калием, рубидием и цезием. Эти реакции являются важными и широко используются в различных областях науки и техники.
Одной из особенностей уравнений водорода с щелочными металлами является их быстрота и интенсивность. Реакции происходят с высокой скоростью и с образованием большого количества энергии. Именно поэтому такие уравнения часто применяются в процессах, где требуется выделение большого количества тепла или быстрое образование газа.
Применение уравнений водорода с щелочными металлами находит важное применение в областях, таких как производство аммиака, водородных попутей, водородного топлива и других важных компонентов в промышленности и научных исследованиях.
Одним из примеров применения уравнений водорода с щелочными металлами является процесс генерации водорода. Водород является одним из самых важных и перспективных энергоносителей, и его производство имеет большое значение для различных отраслей промышленности. Уравнения водорода с щелочными металлами позволяют быстро и эффективно получать водород высокой чистоты.
Таким образом, уравнения водорода с щелочными металлами являются важным инструментом в химической промышленности и научных исследованиях. Их особенности и применение делают их неотъемлемой частью многих процессов, где требуется быстрое образование газа или выделение большого количества тепла. Эти уравнения играют важную роль в производстве водорода и имеют большой потенциал для будущих разработок в области энергетики и окружающей среды.
Энергетический спектр уравнений водорода с щелочными металлами

Уравнения водорода с щелочными металлами представляют собой систему уравнений, описывающих энергетические уровни и переходы между ними в атомах этих металлов с водородным ядром. Энергетический спектр щелочных металлов обладает рядом особенностей, которые связаны с их электронной конфигурацией и химическими свойствами.
В основе энергетического спектра уравнений водорода с щелочными металлами лежит квантовая механика. В соответствии с принципом неразличимости электронов, каждому энергетическому уровню соответствует определенное значение энергии. Эти уровни нумеруются главным квантовым числом n и описываются уравнением Ридберга для водородоподобных атомов.
Щелочные металлы, такие как литий, натрий, калий и др., имеют одну валентную электрон в своей внешней оболочке. Их энергетический спектр состоит из набора уровней, обусловленных взаимодействием этого электрона с водородным ядром и другими электронами в атоме. Важно отметить, что энергетический спектр щелочных металлов имеет сходство с энергетическим спектром водорода, но существуют и отличия, связанные с различными электронными конфигурациями щелочных металлов.
Знание энергетического спектра уравнений водорода с щелочными металлами имеет практическое применение в различных областях науки и техники. Например, изучение энергетических уровней и переходов в атомах щелочных металлов позволяет разрабатывать новые методы спектрального анализа и оптической спектроскопии. Это особенно полезно в атомной физике, квантовой химии, ультрафиолетовой и лазерной спектроскопии.
Квантово-механическое описание уравнения водорода с щелочными металлами
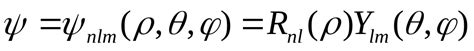
Уравнение водорода с щелочными металлами - это одно из основных уравнений, которое используется для описания поведения электронов в атомах щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и других. Квантово-механическое описание данного уравнения позволяет рассчитать энергетические уровни электрона в атоме и определить вероятность его нахождения в различных областях пространства.
При решении уравнения водорода с щелочными металлами принимается во внимание влияние ядра на электрон. Ядро атома представляется в виде положительно заряженной частицы, вокруг которой движется отрицательно заряженный электрон. Квантово-механическое описание уравнения позволяет учесть взаимодействие этих частиц и определить оптимальные значения энергии электрона.
Для решения уравнения водорода с щелочными металлами применяются различные методы, включая численные и аналитические подходы. Одним из наиболее часто используемых методов является метод Гартри-Фока, который позволяет рассчитать энергетические уровни электрона и определить вклад каждого энергетического уровня в полную энергию системы. Это позволяет более точно описать поведение электрона в атоме щелочного металла.
Квантово-механическое описание уравнения водорода с щелочными металлами имеет большое практическое значение. Оно позволяет предсказать химические свойства щелочных металлов, включая их реакционную способность и возможность образования соединений. Кроме того, данное описание находит широкое применение в различных областях, включая атомную физику, квантовую химию и технологии наноматериалов.
Особенности электронных состояний уравнений водорода с щелочными металлами

Уравнения водорода с щелочными металлами обладают рядом особенностей, касающихся их электронных состояний. Щелочные металлы, такие как литий, натрий, калий и другие, имеют одну валентную электронную оболочку, что делает их электронные структуры более простыми, чем у других элементов.
Одной из особенностей электронных состояний уравнений водорода с щелочными металлами является возможность образования ионов с положительным зарядом. Это объясняется тем, что при потере одного электрона щелочные металлы достигают стабильной электронной конфигурации, а их электронная оболочка становится полностью заполненной. Такие ионы обладают большой химической активностью и широко используются в различных процессах и технологиях.
Другой особенностью электронных состояний уравнений водорода с щелочными металлами является возможность образования взаимодействия между валентным электроном щелочного металла и электроном водорода. Это взаимодействие приводит к образованию молекулы, состоящей из щелочного металла и водорода. Такие молекулы имеют специфические свойства и используются в различных областях науки и промышленности.
Таким образом, электронные состояния уравнений водорода с щелочными металлами имеют свои особенности, которые определяют их химические и физические свойства. Понимание этих особенностей позволяет более полно использовать щелочные металлы и их соединения в различных приложениях и технологиях.
Применение уравнений водорода с щелочными металлами в катализе

Уравнения водорода с щелочными металлами являются важным инструментом в катализе, области химии, изучающей воздействие катализаторов на химические реакции. Щелочные металлы, такие как литий, натрий, калий и др., широко применяются в качестве катализаторов благодаря своим уникальным химическим свойствам.
Уравнения водорода с щелочными металлами позволяют исследовать процессы гетерогенного катализа, в которых катализатор находится в твердом состоянии, а реакционные компоненты - в газообразном. Такие уравнения описывают реакцию между молекулой водорода и поверхностью катализатора.
Применение уравнений водорода с щелочными металлами в катализе имеет широкий спектр применений. Одним из наиболее важных является использование этих уравнений в гетерогенных водородосодержащих реакциях, таких как гидрогенирование органических соединений и дегидрирование аминов. Эти реакции играют ключевую роль в производстве различных химических веществ и материалов, включая фармацевтические препараты, пластмассы и полимеры.
Кроме того, уравнения водорода с щелочными металлами применяются в гомогенных катализаторах, где катализатор находится в одной фазе со всеми реагентами. Это позволяет ускорить реакции, увеличить выход продукта и снизить затраты на производство. Примером таких реакций являются гидролиз алкениламинов и гидрогенирование бензоинов.
Роль уравнений водорода с щелочными металлами в электрохимии

Уравнения водорода с щелочными металлами играют важную роль в электрохимии. Эти уравнения представляют собой реакции, при которых щелочные металлы вступают в реакцию с водой, образуя гидроксиды и выделяяся водород. Такие реакции широко применяются в процессе электролиза и производства водорода.
Уравнения водорода с щелочными металлами имеют большое значение в электрохимии и процессах хранения и использования водорода. Вода является универсальным источником водорода, и использование щелочных металлов позволяет получить его с высокой эффективностью и безопасностью. Эти уравнения также используются для определения концентрации водорода в различных средах и в процессе изучения его свойств и химических реакций.
Уравнения водорода с щелочными металлами обладают рядом особенностей. Например, реакция щелочных металлов с водой происходит с выделением водорода и образованием гидроксида металла. Сила реакции и ее скорость зависят от концентрации щелочного металла и температуры среды. Помимо этого, уравнения водорода с щелочными металлами часто используются для определения стандартного электродного потенциала и других характеристик, связанных с электрохимическими процессами.
Вопрос-ответ

Какие особенности имеют уравнения водорода с щелочными металлами?
Уравнения водорода с щелочными металлами имеют ряд особенностей. Во-первых, они обычно имеют очень простую форму, состоящую из одной структурной единицы: иона водорода, либо иона щелочного металла. Во-вторых, эти уравнения просты в использовании и позволяют проводить реакции с щелочными металлами в различных условиях. В-третьих, уравнения водорода с щелочными металлами играют важную роль в различных процессах и технологиях.
В чем заключается применение уравнений водорода с щелочными металлами?
Уравнения водорода с щелочными металлами широко применяются в научных и промышленных областях. Например, они используются в процессе водородной хлоридации для получения органических соединений, а также в процессе получения водорода для промышленных нужд. Кроме того, уравнения водорода с щелочными металлами играют важную роль в электрохимии, катализе и других областях науки и техники.
Какие щелочные металлы имеют уравнения с водородом?
Уравнения водорода с щелочными металлами имеют следующие металлы: литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Вода, взаимодействуя с этими металлами, образует соответствующие гидроксиды и выделяет водород. Например, уравнение водорода с литием выглядит так: 2Li + 2H₂O → 2LiOH + H₂.
