Химические реакции металлов с кислородом имеют большое значение в области химии и материаловедения. Они происходят, когда металлы взаимодействуют с кислородом воздуха или с кислородом, содержащимся в других соединениях. Результатом таких реакций обычно являются оксиды металлов.
Уравнения химических реакций металлов с кислородом могут быть представлены в виде уравнений окисления и восстановления. Окислители – это вещества, принимающие электроны, тогда как восстановители – это вещества, отдающие электроны. В реакциях металлов с кислородом металлы обычно окисляются, а кислород – восстанавливается.
Например, реакция железа с кислородом можно представить следующим образом:
4Fe + 3O2 → 2Fe2O3
При данной реакции каждая молекула кислорода (O2) принимает электроны от четырех атомов железа (Fe), образуя два атома Fe2O3 – оксида железа.
Изучение уравнений химической реакции металлов с кислородом помогает понять особенности взаимодействия металлов с окружающей средой, а также применять полученные знания в разных областях науки и производства, включая процессы каталитической окисления и защиту металлов от коррозии.
Основные принципы химических реакций

Химическая реакция - это процесс, в результате которого происходит превращение одних веществ в другие с образованием новых связей между атомами. Химические реакции основаны на принципах сохранения вещества и энергии.
Принцип сохранения вещества гласит, что во время химической реакции количество каждого вида атомов должно оставаться неизменным независимо от формы, в которой присутствуют вещества. Другими словами, количество атомов каждого элемента в реагентах должно быть равным количеству атомов этого элемента в продуктах.
Принцип сохранения энергии утверждает, что в химической реакции энергия не создается и не уничтожается, а только преобразуется из одной формы в другую. Во время реакции происходит либерация или поглощение энергии. Признаком химической реакции может быть изменение температуры, выделение света или эмиссия газа.
Химические реакции могут протекать со скоростью, которая зависит от различных факторов, таких как температура, концентрация веществ, поверхность взаимодействующих частиц и наличие катализаторов. Некоторые реакции проходят очень быстро, тогда как другие могут занимать длительное время.
Химические реакции можно записывать с помощью химических уравнений. В уравнениях указываются реагенты (вещества, которые участвуют в реакции) и продукты (вещества, которые образуются в результате реакции). Коэффициенты перед формулами указывают количество молекул или атомов, участвующих в реакции, и должны быть такими, чтобы выполнялись принципы сохранения вещества и энергии.
Металлы и их реакция с кислородом
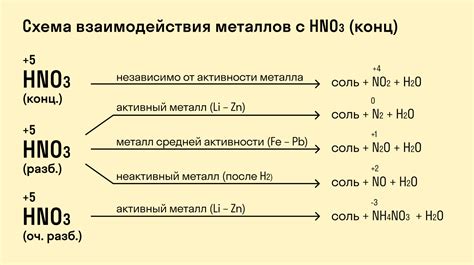
Металлы - это класс веществ, обладающих свойствами хорошего проводника электричества и тепла, а также определенной пластичности и блеска. Одно из интересных свойств металлов - их реакция с кислородом. Реакция металлов с кислородом может протекать с образованием оксидов, которые могут быть как основными, так и кислотными.
Реактивность металлов с кислородом зависит от их электрохимического потенциала. Наиболее активные металлы, такие как литий, натрий и калий, реагируют с кислородом даже при обычных условиях, образуя оксиды. Более пассивные металлы, такие как железо или алюминий, реагируют с кислородом только при нагревании.
Реакция металлов с кислородом может протекать с образованием основного оксида. Например, металл натрий (Na) при взаимодействии с кислородом (O₂) образует оксид натрия (Na₂O). Основные оксиды растворяются в воде, образуя щелочные растворы, например, оксид натрия образует гидроксид натрия (NaOH).
Реакция металлов с кислородом также может протекать с образованием кислотного оксида. Например, металл сера (S) при взаимодействии с кислородом (O₂) образует оксид серы (SO₂). Кислотные оксиды растворяются в воде, образуя кислотные растворы, например, оксид серы образует серную кислоту (H₂SO₄).
Важно отметить, что уравнения реакций металлов с кислородом должны быть сбалансированы, чтобы количество атомов каждого элемента было одинаковым до и после реакции. Таким образом, химические уравнения позволяют наглядно представить процессы, происходящие при реакции металлов с кислородом.
Формулы химических соединений

В химии для обозначения химических соединений используются специальные формулы. Формулы химических соединений состоят из символов химических элементов, а также индексов, которые указывают на количество атомов каждого элемента в молекуле соединения.
Символы химических элементов представлены одной или двумя латинскими буквами, причем первая буква обязательно заглавная. Например, H – водород, O – кислород, Fe – железо.
Индексы, записываемые в нижней части символа элемента или после него, показывают число атомов данного элемента в соединении. Например, H2O – вода (два атома водорода и один атом кислорода), CO2 – углекислый газ (один атом углерода и два атома кислорода).
Формулы химических соединений могут быть простыми, состоящими только из двух элементов, или сложными, включающими больше двух элементов. В сложных формулах используются скобки для обозначения группы атомов. Например, Ca(OH)2 – гидроксид кальция (один атом кальция, два атома кислорода и два атома водорода).
Примеры химической реакции металлов с кислородом
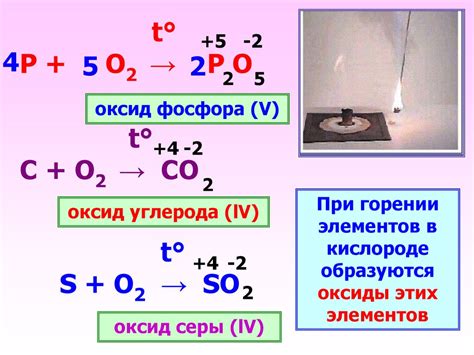
1. Реакция алюминия с кислородом:
Алюминий является активным металлом, и его реакция с кислородом приводит к образованию оксида алюминия (Al2O3). При нагревании алюминия в присутствии кислорода происходит сильное горение, сопровождающееся выделением тепла и света. Реакция выглядит следующим образом:
4 Al + 3 O2 → 2 Al2O3
2. Реакция железа с кислородом:
Железо тоже может реагировать с кислородом, образуя оксид железа (Fe2O3). Эта реакция является основной причиной коррозии железа и его сплавов. Реакция может происходить при нормальных условиях. Уравнение реакции имеет следующий вид:
4 Fe + 3 O2 → 2 Fe2O3
3. Реакция меди с кислородом:
Медь, в отличие от алюминия и железа, не реагирует с кислородом при обычных условиях окружающей среды. Однако, при нагревании меди в присутствии кислорода происходит образование оксида меди (Cu2O). Уравнение реакции имеет следующий вид:
2 Cu + O2 → 2 Cu2O
4. Реакция цинка с кислородом:
Цинк является активным металлом и может быть подвержен окислению при взаимодействии с кислородом. При обычных условиях происходит медленное окисление цинка в воздухе, но при повышенной температуре реакция может протекать быстрее. Окислительно-восстановительное соотношение в реакции между цинком и кислородом принимает следующий вид:
2 Zn + O2 → 2 ZnO
5. Реакция магния с кислородом:
Магний является активным металлом и образует оксид магния (MgO) при взаимодействии с кислородом. Отличительной особенностью реакции магния с кислородом является яркое горение магния при нагревании. Уравнение реакции имеет следующий вид:
2 Mg + O2 → 2 MgO
Вопрос-ответ

Какие металлы реагируют с кислородом?
С кислородом реагируют большинство металлов. Некоторые из них - натрий, магний, алюминий, железо, медь и др.
Что такое уравнение химической реакции?
Уравнение химической реакции - это запись реакции в символической форме, где указываются реагенты и продукты реакции, а также их стехиометрические коэффициенты.
Какая реакция происходит между металлами и кислородом?
Реакция между металлами и кислородом - это окислительно-восстановительная реакция, при которой происходит окисление металла и восстановление кислорода.
Как записывается уравнение реакции металла с кислородом?
Уравнение реакции металла с кислородом записывается в формате: металл + кислород -> оксид металла. Например, 2Na + O2 -> 2Na2O.
