Щелочные металлы, такие как литий, натрий и калий, являются важными элементами в химии и науке в целом. Они обладают множеством уникальных химических свойств, которые определяют их важность и использование в широком спектре промышленных и научных областей. Однако, чтобы полностью понять их свойства и взаимодействия с другими веществами, необходимо разобраться в уравнениях реакций, описывающих их химические превращения.
Уравнения реакций представляют собой запись химических реакций в формальном виде, позволяющем легко анализировать и прогнозировать ход и результаты данных реакций. Для щелочных металлов такие уравнения позволяют понять, как они реагируют с различными веществами, какие продукты образуются при этих реакциях и какие условия необходимы для их протекания.
Например, уравнение реакции между натрием и водой показывает, что при взаимодействии этих веществ образуется водород и образуется гидроксид натрия. Также, уравнения реакций помогают определить количество реагентов и продуктов, исследовать энергетические изменения, происходящие при реакциях, и многое другое.
Важно отметить, что понимание уравнений реакций необходимо не только для практического применения знаний о химических свойствах щелочных металлов, но и для развития фундаментальных принципов химии в целом. Уравнения реакций помогают обнаруживать закономерности в химических процессах, описывать их и объяснять на основе этих закономерностей. Таким образом, изучение уравнений реакций щелочных металлов играет важную роль в формировании учебного материала по химии и позволяет углубить знания в данной научной области.
Реакция щелочных металлов с водой

Реакция щелочных металлов с водой является одним из основных химических свойств этих элементов. Щелочные металлы включают в себя элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
При контакте с водой, щелочные металлы проявляют активность и способность к взаимодействию с молекулами воды. В результате этого взаимодействия образуются щелочная соль и выделяется водород. Реакция происходит с выделением тепла и сопровождается образованием пузырьков газа.
Процесс реакции щелочных металлов с водой можно описать следующим образом: металл атомарно расщепляет молекулу воды, передавая свой электрон водороду. В результате образуется гидроксид металла и выделяется водородный газ, который можно обнаружить с помощью пламени спички или отдельного горелки.
Такие реакции являются характерными для всех щелочных металлов, однако их активность может отличаться. Например, литий и натрий проявляют более высокую реактивность по сравнению с калием.
Реакция щелочных металлов с водой является важным понятием в химии и имеет практическое применение. Эта реакция используется, например, для получения гидроксидов щелочных металлов, которые широко применяются в различных областях, включая производство мыла, стекла, щелочных аккумуляторов и т.д.
Реакция щелочных металлов с кислородом
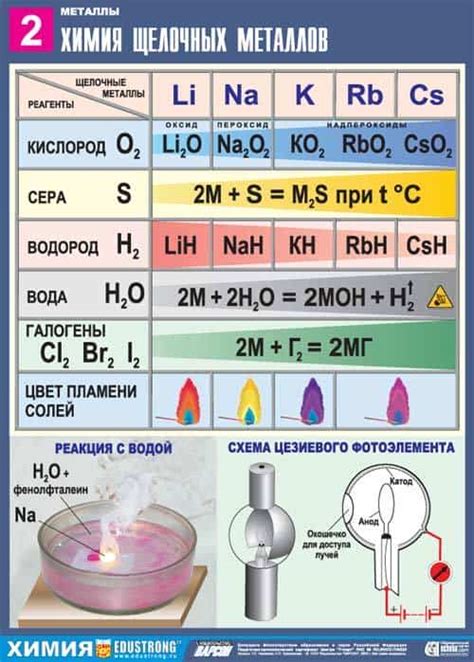
Реакция щелочных металлов с кислородом – это химическая реакция, в результате которой образуются оксиды щелочных металлов. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, легко соединяются с кислородом, поскольку их внешний электронный уровень содержит только один электрон.
В ходе реакции щелочные металлы реагируют с кислородом, образуя оксиды. Уравнение реакции обычно записывается в следующем виде: М + О2 -> МО, где М обозначает щелочный металл. Например, реакция лития с кислородом приводит к образованию оксида лития (Li2O).
Реакция щелочных металлов с кислородом происходит очень быстро и сопровождается выделением тепла и света. Кроме того, оксиды щелочных металлов являются основаниями, которые взаимодействуют с водой, образуя соответствующие гидроксиды. Эта реакция также очень экзотермическая и сопровождается выделением тепла.
Реакции щелочных металлов с кислородом имеют большую практическую значимость. Например, оксид натрия (Na2O) и оксид калия (K2O) используются в процессе производства стекла, где они работают в качестве расплавляющих агентов и придают стеклу особые свойства. Более того, реакция щелочных металлов с кислородом является важным фундаментальным понятием в химии, позволяющим понять основные свойства щелочных металлов и продукты их реакций.
Реакция щелочных металлов с кислотами

Реакция щелочных металлов с кислотами является одним из важнейших химических процессов, позволяющих понять основные свойства щелочных металлов.
При взаимодействии щелочных металлов, таких как натрий (Na), калий (K) и литий (Li), с кислотами образуется соль и выделяется водород. Реакция протекает с выделением большого количества тепла, что делает ее заметной.
Реактивность щелочных металлов с кислотами связана с тем, что они обладают низкой электроотрицательностью и легко отдают свой электрон. Под действием кислоты происходит процесс обезводнения металла, который принимает в себя на себя кислород от основания.
Примеры реакции щелочных металлов с кислотами:
- Натрий (Na) + серная кислота (H2SO4) → натрий сульфат (Na2SO4) + водород (H2)
- Калий (K) + хлороводородная кислота (HCl) → хлорид калия (KCl) + водород (H2)
- Литий (Li) + азотная кислота (HNO3) → нитрат лития (LiNO3) + водород (H2)
Реакция щелочных металлов с кислотами может использоваться для получения солей и водорода, а также в химическом анализе для определения концентрации кислот по количеству выделившегося водорода.
Реакция щелочных металлов с неметаллами
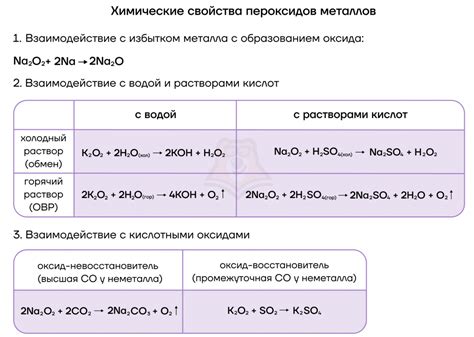
Щелочные металлы - это элементы, которые принадлежат первой группе периодической таблицы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают высокой реактивностью и легко взаимодействуют с неметаллами, образуя различные соединения.
Реакции щелочных металлов с неметаллами происходят с образованием ионов, в результате чего образуются соли или оксиды. Например, щелочные металлы реагируют с хлором (Cl) и образуют соответствующие хлориды, такие как хлорид лития (LiCl), хлорид натрия (NaCl) и т.д. Эти хлориды являются ионными соединениями и растворяются в воде, образуя электролитические растворы.
Также щелочные металлы могут реагировать с кислородом (O) и образовывать оксиды. Например, реакция калия с кислородом приводит к образованию оксида калия (K2O). Оксиды щелочных металлов являются основными оксидами и обладают щелочными свойствами.
Важно отметить, что реакции щелочных металлов с неметаллами обычно сопровождаются выделением тепла и образованием взрывоопасных соединений. Поэтому при обращении с щелочными металлами необходимо соблюдать осторожность и принимать меры безопасности.
Реакция щелочных металлов с другими соединениями и веществами

Щелочные металлы, такие как литий, натрий, калий, реагируют с водой, образуя щелочное гидроксидное соединение и выходят водород. Это реакция между активным металлом и водой называется щелочной реакцией. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O -> 2NaOH + H2
Эта реакция является экзотермической и происходит с выделением тепла.
Щелочные металлы также реагируют с кислородом из воздуха, образуя оксид металла. Например, реакция натрия с кислородом выглядит следующим образом:
4Na + O2 -> 2Na2O
Кроме того, щелочные металлы могут реагировать с неметаллами, образуя соль. Например, реакция натрия с хлором выглядит следующим образом:
2Na + Cl2 -> 2NaCl
Важно отметить, что реактивность щелочных металлов возрастает по группе: литий наиболее реактивен, а калий - наименее реактивен.
Вопрос-ответ

Зачем нужны уравнения реакций?
Уравнения реакций используются для описания химических превращений, которые происходят между веществами. Они помогают понять, какие вещества образуются в результате реакции и в каких пропорциях. Также уравнения реакций могут помочь определить, какие физические и химические свойства имеют вещества, участвующие в реакции.
Как правильно составлять уравнения реакций?
Для правильного составления уравнения реакции необходимо следовать определенным правилам. Вначале нужно записать формулы веществ, участвующих в реакции. Затем необходимо сбалансировать уравнение, то есть установить правильные коэффициенты перед каждым веществом, чтобы число атомов каждого элемента было одинаковым на обоих сторонах уравнения. Таким образом, правильно составленное уравнение реакции позволяет описать химическую реакцию без нарушения закона сохранения массы и закона сохранения заряда.
Какие химические свойства характерны для щелочных металлов?
Щелочные металлы обладают рядом характерных химических свойств. Они активно реагируют с водой, образуя гидроксиды и выделяя водород. Также щелочные металлы реагируют с кислородом, образуя оксиды. Щелочные металлы очень реакционны и легко окисляются. Они образуют соли со многими кислотами и могут вытеснять другие металлы из их соединений. Щелочные металлы обладают высокой электропроводностью и используются в различных электрохимических процессах.
