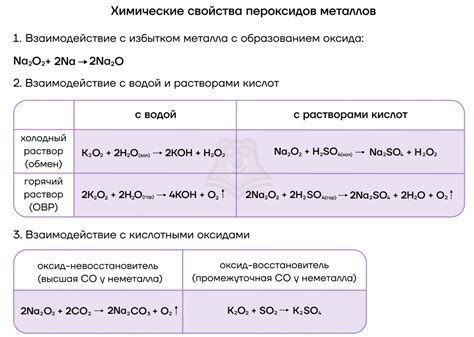
Щелочные металлы, такие как литий, натрий, калий и др., являются наиболее активной группой элементов в периодической системе. Они реагируют с водой и другими реагентами, образуя соли. Реакции солей щелочных металлов происходят по определенным уравнениям, которые можно изучить для лучшего понимания процессов, происходящих во время химических реакций.
Одной из наиболее характерных реакций солей щелочных металлов является реакция с водой. В ходе этой реакции, соль щелочного металла и вода взаимодействуют, образуя гидроксид щелочного металла и выделяя водород. Уравнение этой реакции выглядит следующим образом:
2 MХ + 2 H₂O → 2 МОН + Н₂
Гидроксиды щелочных металлов являются щелочными растворами и обладают высокой щелочностью. Они широко используются в промышленности и в быту. Например, гидроксид натрия (натр н, каустическая сода) применяется в производстве стекла, мыла, а также используется в бытовых целях как бытовое щелочное средство. Гидроксиды щелочных металлов также используются в лабораторной практике при проведении различных аналитических и синтетических реакций.
Реакции солей щелочных металлов
Щелочные металлы - это элементы первой группы периодической таблицы, такие как литий, натрий, калий и др. Соли щелочных металлов широко используются в различных областях, от химической промышленности до медицины.
Реакции солей щелочных металлов обладают рядом особенностей. Как правило, соли щелочных металлов растворяются в воде и образуют ионы металла и анионы. Например, реакция растворения хлорида натрия:
NaCl + H2O → Na+ + Cl- + H2O
Растворенные ионы щелочных металлов могут взаимодействовать с другими реагентами, приводя к различным реакциям. Например, реакция замещения:
2NaCl + H2SO4 → Na2SO4 + 2HCl
Кроме того, соли щелочных металлов могут образовывать осадки при реакции с некоторыми реагентами. Например, реакция осаждения хлорида кальция и карбоната натрия:
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Также соли щелочных металлов оказывают влияние на химическую реакцию вследствие своей ионной природы. Они могут быть использованы как катализаторы, ускоряющие химические процессы.
Вывод: реакции солей щелочных металлов являются важным объектом изучения в химии. Они обладают рядом особенностей и находят множество применений как в научных исследованиях, так и в промышленности.
Уравнения реакций
Уравнения реакций представляют собой химические выражения, показывающие, как вещества превращаются в процессе химической реакции. В случае реакций солей щелочных металлов уравнения описывают взаимодействие солей с другими веществами.
Уравнения реакций солей щелочных металлов обычно состоят из реакционных веществ, указанных слева от стрелки, и продуктов реакции, указанных справа от стрелки. Реагенты и продукты могут быть записаны в виде формул веществ или с помощью химических символов.
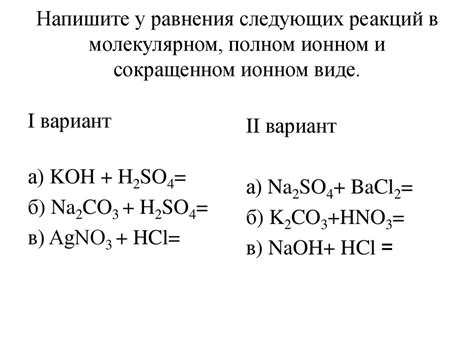
Уравнения реакций солей щелочных металлов могут быть как простыми, так и сложными. Например, простое уравнение может выглядеть следующим образом: NaCl + AgNO3 → AgCl + NaNO3. В этой реакции хлорид натрия (NaCl) взаимодействует с нитратом серебра (AgNO3), образуя хлорид серебра (AgCl) и нитрат натрия (NaNO3).
Сложные уравнения реакций солей щелочных металлов могут включать несколько реагентов и продуктов. Например: 2NaOH + H2SO4 → Na2SO4 + 2H2O. Это уравнение описывает реакцию гидроксида натрия (NaOH) с серной кислотой (H2SO4), в результате которой образуется сульфат натрия (Na2SO4) и вода (H2O).
Использование уравнений реакций позволяет ученым и химикам понять и описать химические процессы, происходящие во время реакций солей щелочных металлов. Уравнения позволяют предсказывать реакционные продукты, определить коэффициенты реакции и изучать влияние условий на химические превращения.
Особенности реакций

Реакции солей щелочных металлов обладают рядом особенностей, которые оказывают влияние на их химические свойства и проявления:
- Растворение в воде. Большинство солей щелочных металлов хорошо растворимы в воде, образуя ионы металла и соответствующие ионы кислотных радикалов. Это обуславливает их высокую реакционную способность и широкое применение.
- Устойчивость соединений. Соли щелочных металлов обычно устойчивы и не подвергаются разложению при нормальных условиях. Однако, некоторые соли, например нитраты, могут быть высоко реакционноспособными и даже взрывоопасными при некоторых условиях.
- Реактивность. Щелочные металлы обладают высокой реакционной способностью, что проявляется в их способности вступать в химические реакции с другими веществами. Они легко образуют соединения с кислородом, серой, галогенами и другими элементами, а также с неорганическими и органическими кислотами.
Кроме того, соли щелочных металлов могут образовывать комплексные соединения с различными лигандами, что расширяет их химические возможности и позволяет использовать их в различных областях, включая промышленность и медицину.
Вопрос-ответ

Какие особенности имеют реакции солей щелочных металлов?
Реакции солей щелочных металлов имеют несколько особенностей. Во-первых, равновесие в таких реакциях смещено вправо, что означает, что реакция обычно проходит полностью и соль полностью растворяется. Во-вторых, реакции солей щелочных металлов обычно сопровождаются образованием щелочи. Например, при растворении хлорида натрия в воде образуется гидроксид натрия, что делает раствор щелочным. Также, реакции солей щелочных металлов обычно сопровождаются образованием осадка или газа.
Какие уравнения можно использовать для описания реакций солей щелочных металлов?
Для описания реакций солей щелочных металлов используются различные химические уравнения. Например, растворение соли щелочного металла может быть представлено следующим уравнением: XCl + H2O ⟶ XOH + HCl, где X - щелочной металл. Также, реакция соли щелочного металла с кислотой может быть описана уравнением: XCl + HCl ⟶ XOH + Cl2. В зависимости от конкретных условий реакции, могут быть использованы и другие уравнения для описания реакций солей щелочных металлов.
