Водород является одним из наиболее распространенных элементов в природе и обладает широким спектром применений. Одним из способов получения водорода является реакция металлов с различными соединениями. Такие реакции проходят в присутствии катализаторов и при определенных температурах.
Самым распространенным процессом получения водорода является реакция металла с кислородом. Например, при нагревании металлического кальция с водой, образуется оксид кальция и молекулярный водород. Этот процесс иллюстрирует принцип общей реакции:
Металл + Вода → Оксид металла + Водород
Помимо реакции металла с водой, существуют и другие реакции с металлами, позволяющие получить водород. Например, реакция металла с кислотой. При этом образуются соли металла и молекулярный водород. Некоторые металлы, такие как цинк или алюминий, реагируют с кислотой даже без нагревания, в то время как другие металлы, такие как железо или медь, реагируют только при нагревании.
Процессы взаимодействия металлов и получение водорода
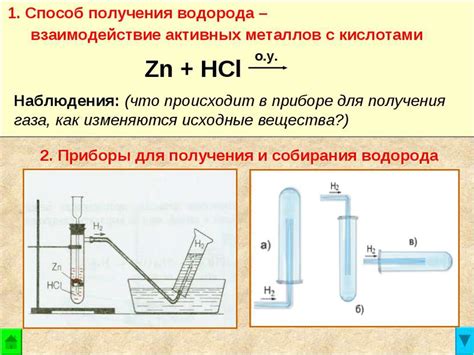
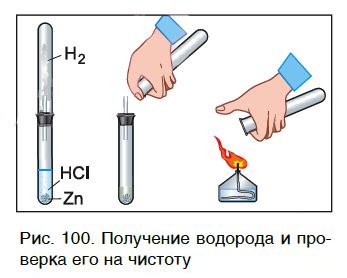
Металлы, такие как цинк, железо, алюминий и магний, играют важную роль в процессе получения водорода. Они могут реагировать с различными веществами, такими как кислоты или водные растворы, и выделять водородный газ.
Одним из наиболее распространенных процессов является реакция металла с кислотой. Например, цинк реагирует с соляной кислотой, выделяя водородный газ. Эта реакция может быть представлена в виде химического уравнения:
Zn + 2HCl → ZnCl2 + H2
Другим способом получения водорода с использованием металлов является их реакция с водой. Например, алюминий реагирует с водой, образуя оксид алюминия и выделяя водород. Уравнение этой реакции выглядит следующим образом:
2Al + 3H2O → Al2O3 + 3H2
Для увеличения скорости реакции и облегчения процесса получения водорода, может использоваться катализатор, например, платина. Катализатор ускоряет химическую реакцию без участия в самой реакции.
Также существует процесс электролиза, в котором водород получается из воды путем разложения на отрицательно заряженном электроде, аноде. Этот процесс требует применения электрического тока и специального оборудования.
Таким образом, процессы взаимодействия металлов и получение водорода играют значительную роль в современной технологии и имеют широкое применение в различных отраслях, таких как производство водородных топливных элементов и химической промышленности.
Химический состав водорода и его реакции с металлами

Водород - это химический элемент, обозначаемый символом H и имеющий атомный номер 1. В природе он наиболее распространен в составе воды, где образует соединение с кислородом. Кроме того, водород может быть получен путем химических реакций с металлами.
Реакции водорода с металлами являются эндотермическими процессами, при которых вещества поглощают тепловую энергию из окружающей среды. В результате таких реакций образуются соединения, называемые гидридами. Гидриды могут иметь различную структуру и свойства в зависимости от металла, с которым взаимодействует водород.
Некоторые металлы, такие как литий, натрий и калий, реагируют с водородом при обычных условиях. В результате образуются металлические гидриды, которые являются стабильными и обладают высокой воспламеняемостью. Гидриды этих металлов используются в качестве источников водорода в различных технологических процессах и при производстве водородных топливных элементов.
Другие металлы, такие как железо, цинк и алюминий, реагируют с водородом при повышенных температурах и давлениях. В результате образуются бинарные соединения, в которых водород выступает в роли отрицательного иона. Такие соединения также используются в процессах получения водорода и имеют важное промышленное применение.
Реакции водорода с металлами имеют большое значение как в научных исследованиях, так и в практическом применении. Изучение этих реакций позволяет расширить наши знания о химических свойствах металлов и разработать новые технологии производства и использования водорода в различных отраслях промышленности.
Термические реакции получения водорода и их применение
Термические методы получения водорода используются широко в промышленном масштабе. Одним из основных методов является паровая реформинговая реакция углеводородов. В результате данной реакции образуется смесь водорода и углекислого газа, которую можно использовать во множестве отраслей: в производстве аммиака, метанола, водородной перекиси, а также в синтезе синтетических топлив.
Другим термическим методом получения водорода является разложение воды при высоких температурах. В результате данной реакции образуется водород и кислород, которые можно отделить друг от друга. При этом водород можно использовать в качестве топлива, например, в водородных топливных элементах для электромобилей. Также водород используется в процессе гидрогенизации различных органических соединений.
Реакции получения водорода тепловыми методами имеют ряд преимуществ. Во-первых, термические методы обладают высокой эффективностью, что позволяет получать большие объемы водорода. Во-вторых, реакции осуществляются при относительно высоких температурах, что обеспечивает достаточно быструю скорость процесса.
Термические реакции получения водорода являются важным этапом в развитии водородной энергетики и экологически чистых технологий. Водородное топливо считается одним из наиболее перспективных источников энергии, так как оно не выделяет вредных выбросов в атмосферу и может быть использовано в различных областях, от транспорта до производства электроэнергии.
Электролитические методы получения водорода из металлов
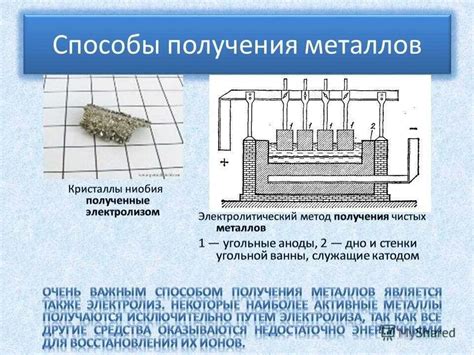
Одним из эффективных методов получения водорода являются электролитические процессы с металлами. Данные методы основаны на использовании электролиза, при котором происходит разложение воды на кислород и водород под воздействием постоянного электрического тока.
Для электролитической генерации водорода из металлов применяют различные электролиты, такие как серная кислота, щелочные растворы и даже расплавы солей. Водород образуется на катоде при реакции редукции, а на аноде происходит окисление металла или его соединения.
Преимущества электролитических методов в получении водорода из металлов заключаются в их экономической эффективности и экологической чистоте. Этот метод позволяет получать высококачественный водород с высокой степенью чистоты, что делает его применение в различных промышленных отраслях более удобным и безопасным.
Реализация электролитических методов получения водорода из металлов требует определенного оборудования, включающего электролитические ячейки и источники постоянного электрического тока. Кроме того, необходимо контролировать температуру, концентрацию электролита и другие параметры, чтобы обеспечить эффективность и качество процесса.
Фотохимическое воздействие на металлы и выделение водорода
Фотохимическое воздействие – это процесс, при котором световая энергия поглощается металлической поверхностью и инициирует химические реакции. Ключевую роль в таких процессах играют электрохимические процессы, приводящие к выделению водорода.
Когда на металлы падает свет, он вызывает внешнеэлектрический эффект фотоположительного заряда. В результате этого процесса происходит абсорбция молекулярного кислорода, что приводит к окислению поверхностных мест и возникновению дефицита электронов. Эта реакция называется фотокатодным процессом.
Когда металл окисляется, происходит электронный перенос вокруг поверхности металла, что приводит к реакции выделения водорода. Фотохимическое воздействие на металлы может усиливаться с помощью катализаторов, таких как платина или радиоактивные вещества.
Существуют различные способы фотокатодного процесса. Например, фотохимическое разложение воды на водород и кислород может осуществляться с помощью фотоэлектролиза, при котором используется специально созданное электропроводящее соединение. Варианты фотохимического воздействия на металлы и выделения водорода могут быть разнообразными и зависят от конкретных условий исследования.
Биологические процессы получения водорода и их возможности применения
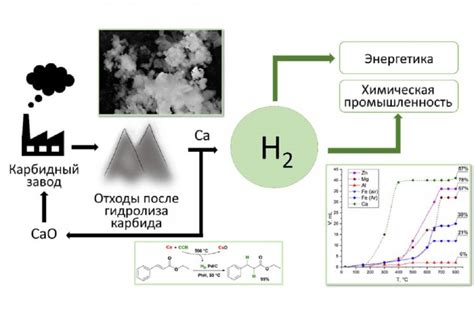
Водород может быть получен не только при промышленных процессах, но и в результате биологических реакций. Водородный метаболизм у многих организмов, включая бактерии и водные растения, основан на ферментативном разложении органических веществ с образованием молекулярного водорода.
Одним из наиболее активных бактерий, способных синтезировать и выпускать водород, являются фототрофные бактерии. Они способны использовать свет для преобразования пигментов хлорофилла и других фотосинтетических пигментов в химическую энергию. В результате этого, светопоглощающие пигменты создают электрохимический градиент, который приводит к активации ферментов, синтезирующих водород. Это процесс, известный как фотоционизация.
Биологический процесс получения водорода можно использовать для нескольких практических целей. Водород может быть использован как альтернативное топливо, поскольку его сжигание не производит выбросов парниковых газов, а лишь образует воду. Бактерии, способные синтезировать водород, могут также быть использованы для очистки сточных вод и улавливания углекислого газа. Это позволяет одновременно решить проблемы экологии и энергетики.
Существуют и другие возможности применения биологических процессов получения водорода. Например, водородный метаболизм бактерий может быть использован для производства пищевых добавок и лекарственных препаратов. Также известно, что водород способен улучшать рост и развитие растений, что открывает новые возможности для сельского хозяйства и оранжерейного выращивания.
Вопрос-ответ

Какие металлы можно использовать в процессах получения водорода?
В процессах получения водорода чаще всего используются такие металлы, как алюминий, железо и магний. Эти металлы обладают способностью реагировать с кислородом или водой, образуя гидроксиды или оксиды, при этом высвобождая водород. Однако, также возможно использование других металлов, включая цинк, никель и титан.
Какие преимущества имеет использование металлов в процессах получения водорода?
Использование металлов в процессах получения водорода имеет ряд преимуществ. Во-первых, металлы широко распространены и дешевы, поэтому это дешевый и практически неисчерпаемый источник водорода. Во-вторых, реакции с металлами обычно протекают при невысоких температурах и без необходимости использования сложного оборудования. Наконец, металлы могут быть легко и безопасно хранены и транспортированы в виде компактных и стабильных материалов.
