Уравнения реакции по цепочке металлы - это основной метод для представления химических реакций между различными металлами. Этот метод включает в себя серию последовательных реакций, где каждая последующая реакция идет на основе продуктов предыдущей реакции. Он широко используется в химии для анализа и предсказания поведения металлов в различных химических реакциях.
Основной принцип уравнений реакции по цепочке металлы основан на том, что реакция между металлами может происходить путем обмена электронами. В таких реакциях, один металл отдает электроны, становясь положительно заряженным ионом, а другой металл принимает эти электроны, становясь отрицательно заряженным ионом. Это позволяет металлам создавать стабильное соединение с низкой энергией и достигать стабильного электронного состояния.
Примеры уравнений реакций по цепочке металлы включают такие реакции, как реакция между железом и медью, алюминием и свинцом, цинком и магнием. В каждом случае, металл с более низкой электроотрицательностью отдает электроны металлу с более высокой электроотрицательностью. Такие реакции особенно важны в анодных процессах, таких как электролиз, гальванический элемент и другие электрохимические реакции.
Основные принципы уравнений реакции по цепочке металлы

Уравнения реакции по цепочке металлы являются методом описания и расчета химических реакций, происходящих между различными металлами. Этот метод основан на принципе процесса расчета электролитической диссоциации, с помощью которого можно предсказать продукты реакции и рассчитать их концентрации.
Основными принципами уравнений реакции по цепочке металлы являются: использование таблицы потенциалов стандартных электродных потенциалов, принцип сохранения электрического заряда и принцип регулирования направления реакции.
Таблица потенциалов стандартных электродных потенциалов содержит информацию о потенциалах окисления и восстановления для различных металлов. Используя эту таблицу, можно определить потенциал реакции и предсказать, какая реакция будет протекать.
Принцип сохранения электрического заряда указывает на то, что сумма зарядов на аноде и катоде должна быть равна нулю. Это позволяет более точно предсказывать, какие соединения образуются в результате реакции.
Принцип регулирования направления реакции подразумевает, что реакция будет идти в том направлении, где разность потенциалов между двумя металлами будет наибольшей. Это помогает определить, какой металл будет окислен, а какой – восстановлен в процессе реакции.
Реакции переноса электронов
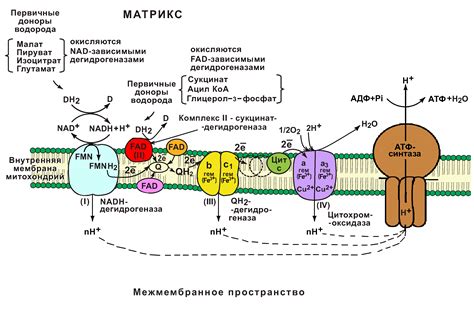
Реакции переноса электронов — это химические реакции, в которых электроны переносятся с одного вещества на другое. Они могут происходить между атомами, ионами или молекулами. Такие реакции играют важную роль в многих биологических и физических процессах.
В реакциях переноса электронов важную роль играют вещества, которые могут отдавать или принимать электроны. Вещества, которые отдают электроны, называются окислителями, а вещества, которые принимают электроны, называются восстановителями.
Процесс переноса электронов может происходить в виде односторонней реакции, когда одно вещество окисляется, а другое восстанавливается. Он может также происходить в виде обратимой реакции, когда электроны переносятся в обоих направлениях.
Для уравновешивания реакций переноса электронов используется метод полуреакций. В этом методе каждая полуреакция, в которой происходит либо окисление, либо восстановление, записывается отдельно. Затем оба уравнения комбинируются так, чтобы количество перенесенных электронов было одинаковым в обоих полуреакциях.
Реакции переноса электронов широко используются в химической промышленности и в синтезе органических соединений. Они также играют важную роль в электрохимии и биохимии, где участвуют различные ферменты и металлы.
Влияние концентрации веществ на скорость реакций

Концентрация веществ является одним из факторов, влияющих на скорость химических реакций. Чем выше концентрация реагирующих веществ, тем быстрее протекает реакция. Это связано с тем, что при увеличении концентрации увеличивается вероятность столкновений между молекулами, что способствует образованию новых связей и образованию продуктов реакции.
Увеличение концентрации веществ также увеличивает количество частиц в данном объеме реакционной смеси, что приводит к увеличению вероятности столкновений и, следовательно, к увеличению вероятности успешной реакции между частицами. Таким образом, концентрацию веществ можно рассматривать как меру плотности реакционной смеси и ее "насыщенности" реагентами.
Влияние концентрации на скорость реакции можно наглядно представить с помощью графика. При увеличении концентрации реагирующих веществ график зависимости скорости реакции от времени становится более крутым, что говорит о более быстром протекании реакции с увеличением концентрации.
Однако следует отметить, что существует определенный предел влияния концентрации на скорость реакции. После достижения определенной концентрации, увеличение ее дальше уже не будет существенно влиять на скорость реакции. Это объясняется тем, что достаточная плотность реагентов и так уже обеспечивает достаточное количество столкновений искомого типа.
Роль катализаторов в уравнениях реакции
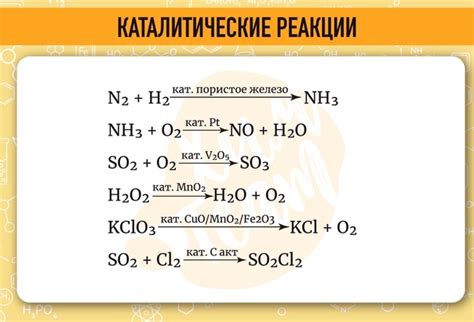
Катализаторы играют важную роль в химических реакциях, ускоряя и облегчая процессы, происходящие между реагентами. Они не расходуются при реакции и могут многократно участвовать в различных циклических превращениях.
В уравнениях реакции катализаторы обычно указываются над стрелкой в скобках. Они влияют на скорость реакции, снижая энергетический барьер для прохождения этапов. Это позволяет увеличить скорость реакции и снизить температуру и давление, необходимые для ее проведения.
Примеры катализаторов в уравнениях реакции могут включать металлы, такие как платина, родий и никель, которые применяются в гетерогенной катализе. Они обладают поверхностью, на которой происходят реакции между молекулами реагентов.
Катализаторы могут также быть органическими соединениями, такими как ферменты или другие биологически активные вещества. Они играют решающую роль в биохимических процессах, управляя синтезом и распадом молекул.
Роль катализаторов в уравнениях реакции нельзя недооценивать, поскольку они позволяют существенно улучшить эффективность и экономику многих химических процессов. Они способствуют снижению затрат на энергию, повышению выборки продуктов и уменьшению количества отходов.
Вопрос-ответ

Для чего нужно уравнение реакции по цепочке металлы?
Уравнение реакции по цепочке металлы используется для описания химической реакции, в которой металл замещает другой металл в соединении. Оно помогает прогнозировать, как будет протекать реакция и какие продукты сформируются.
Какие принципы лежат в основе уравнения реакции по цепочке металлы?
Основные принципы уравнения реакции по цепочке металлы включают принцип активности металлов, при котором металл с более высокой активностью замещает металл с более низкой активностью в его соединении, и принцип непрерывности металлической активности, согласно которому металлы могут быть размещены в порядке убывания их активностей.
