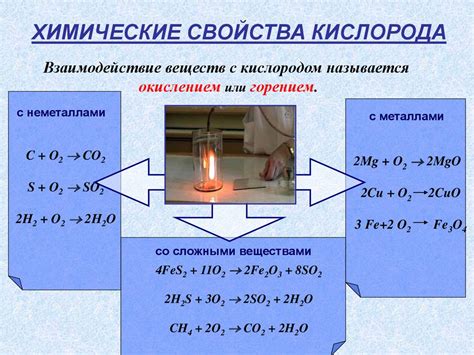
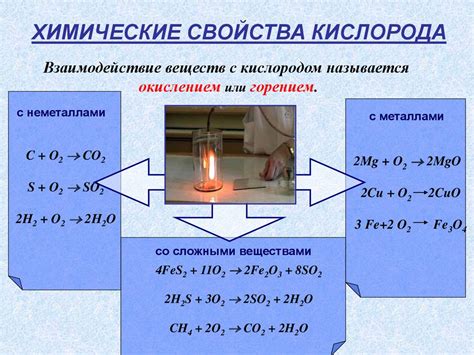
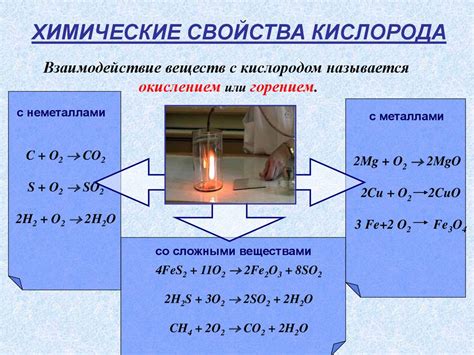
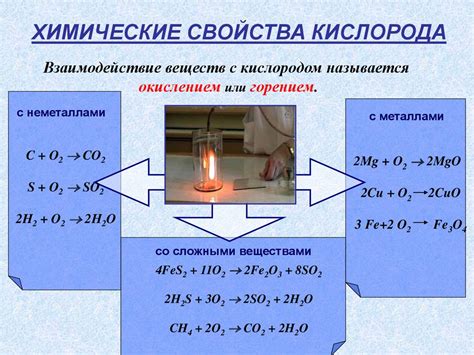
Реакция кислорода с металлами является важной химической реакцией, позволяющей получать металлические оксиды. Кислород является одним из самых распространенных элементов в природе и активным окислителем, поэтому его реакция с металлами неизбежна.
Уравнения реакций кислорода с металлами имеют общую формулу: металл + кислород → металлический оксид. В результате этой реакции происходит окисление металла и образование оксида. Например, уравнение реакции кислорода с железом выглядит следующим образом: 4 Fe + 3 O2 → 2 Fe2O3. Это означает, что 4 атома железа реагируют с 3 молекулами кислорода и образуется 2 молекулы железа(III) оксида.
В зависимости от свойств металла и условий реакции формула оксида может быть разной. Некоторые оксиды образуют щелочные растворы, другие - кислотные. Например, алюминий образует кислый оксид (Al2O3), который растворяется в щелочи, образуя соль - гидроксид алюминия.
Уравнения реакций кислорода с металлами играют важную роль в промышленности и научных исследованиях. Они позволяют производить различные металлические оксиды, которые находят применение в производстве керамики, красок, стекла, катализаторов и других продуктов.
Химия и свойства кислорода
Кислород — это химический элемент с атомным номером 8 и обозначением O. Он является одним из наиболее распространенных элементов в Земной атмосфере и находится во многих органических и неорганических соединениях.
Кислород является очень активным элементом и образует множество соединений с другими элементами. Однако его реактивность неодинакова в различных условиях. При нормальных условиях кислород не реагирует с веществами, такими как железо и алюминий. Однако при нагревании или в условиях высокого давления, кислород может образовывать окислы с этими металлами.
Кислород также проявляет себя как окислитель. Он может отдавать электроны другим элементам во время химических реакций. Например, когда кислород соединяется с водородом, образуется вода. Кислород также может окислять другие вещества, превращая их в оксиды. Например, его реакция с углем приводит к образованию углекислого газа.
Кислород очень важен для поддержания жизни на Земле. Он не только необходим для дыхания всех живых организмов, но и играет важную роль в процессах сгорания и окисления. Кислород также используется в различных промышленных процессах, таких как обработка металлов и производство химических соединений.
В заключение, кислород — это важный элемент, обладающий множеством уникальных свойств. Его реакции с металлами и другими веществами являются основой для многих химических процессов и имеют большое значение как в природе, так и в промышленности.
Взаимодействие кислорода с щелочными металлами:
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), сильно взаимодействуют с кислородом. Этот процесс приводит к образованию оксидов металлов.
Оксиды щелочных металлов являются основаниями и обладают высокой щелочностью. Они широко применяются в производстве стекла, щелочных батарей, керамики и других промышленных процессах.
Взаимодействие кислорода с щелочными металлами происходит при нагревании металла до высоких температур. Частицы кислорода проникают в структуру металла и взаимодействуют с его атомами, образуя оксид. Формула оксида зависит от конкретного металла и может быть определена по его химическому символу.
Например, оксид лития имеет формулу Li2O, оксид натрия - Na2O, а оксид калия - К2О. Эти соединения обладают высокой степенью растворимости в воде и могут реагировать с водой, образуя щелочи.
Интересно отметить, что взаимодействие кислорода с щелочными металлами происходит достаточно интенсивно, поэтому эти металлы хранятся в специальных средах, либо обрабатываются защитными слоями, чтобы предотвратить их окисление.
Реакции кислорода с щёлочноземельными металлами:
Щёлочноземельные металлы, такие как магний, кальций, стронций и барий, обладают особенностями в реакциях с кислородом. Кислород, будучи химически активным элементом, образует оксиды с металлами, включая щёлочноземельные. Реакция между кислородом и щёлочноземельным металлом приводит к образованию соответствующих металлических оксидов, в которых металл находится в более высокой степени окисления.
Например, магний, первый щёлочноземельный металл, реагирует с кислородом, образуя оксид магния (MgO). Эта реакция является оксидацией магния и происходит с выделением тепла. Оксид магния широко используется в промышленности и быту, например, в производстве огнеупорных материалов или в качестве антиоксиданта в пищевой промышленности.
Кальций и другие щёлочноземельные металлы реагируют с кислородом аналогичным образом, образуя соответствующие оксиды. Например, кальций реагирует с кислородом, образуя оксид кальция (CaO), который известен как известь. Известь широко используется в строительстве, сельском хозяйстве и других отраслях.
На основе реакций кислорода с щёлочноземельными металлами можно сделать вывод, что эти металлы обладают высокой химической активностью. Реакции с кислородом у щёлочноземельных металлов обусловлены стремлением металлов к достижению электронной конфигурации инертного газа. Как результат, образуются стабильные соединения в виде оксидов, которые имеют разнообразные применения в промышленности и других сферах деятельности.
Уравнения реакций кислорода с лёгкими металлами:

Кислород является одним из самых активных химических элементов, поэтому способен вступать в реакцию с различными веществами. Особенно яркими реакциями являются взаимодействия кислорода с лёгкими металлами. Эти реакции обычно сопровождаются интенсивным выделением энергии и света.
Одной из наиболее известных реакций является горение магния в кислороде. Уравнение реакции выглядит следующим образом:
2Mg + O2 → 2MgO. При этой реакции образуется оксид магния.
Аналогичным образом реагируют и другие лёгкие металлы, например, натрий. Если нагреть натрий в кислороде, произойдет взрывоопасное взаимодействие. Уравнение реакции принимает вид: 4Na + O2 → 2Na2O. В результате образуется оксид натрия.
Кстати, кислород может вступать также в реакцию с алюминием. В этом случае образуется оксид алюминия. Уравнение реакции выглядит так: 4Al + 3O2 → 2Al2O3. Такая реакция также сопровождается ярким свечением и выделением тепла.
Итак, уравнения реакций кислорода с лёгкими металлами являются интересными и специфичными. Они демонстрируют живой химический процесс и позволяют нам увидеть, насколько активным может быть кислород во взаимодействии с различными веществами.
Взаимодействие кислорода с переходными металлами:
Переходные металлы представляют особый класс элементов, которые обладают способностью образовывать различные оксиды при взаимодействии с кислородом. Оксиды переходных металлов являются важными соединениями, используемыми в различных сферах научного и технического прогресса.
Взаимодействие кислорода с переходными металлами протекает по различным сценариям в зависимости от конкретного металла и условий реакции. Некоторые переходные металлы (например, железо, медь, никель) образуют оксиды с различными степенями окисления, такие как Fe2O3, CuO, NiO. Другие металлы, такие как марганец и ванадий, могут образовывать несколько различных оксидов с различными степенями окисления. Например, марганец образует оксиды MnO, MnO2 и Mn2O3.
Взаимодействие кислорода с переходными металлами может происходить не только в виде образования оксидов, но также в виде образования пероксидов и супероксидов. Например, пероксид водорода, H2O2, может взаимодействовать с переходными металлами, такими как марганец и железо, образуя соответствующие пероксиды металлов. Супероксид ион O2- также может вступать в реакции с переходными металлами, образуя соответствующие супероксиды.
Выводя взаимодействие кислорода с переходными металлами на новый уровень, существуют и более сложные реакции, такие как окислительная реакция, в которой переходный металл окисляется кислородом, или редукционная реакция, в которой переходный металл восстанавливается за счет кислорода. Такие реакции являются важным объектом изучения в области химии переходных металлов.
Реакции кислорода с благородными металлами:

Кислород является одним из наиболее активных элементов в природе и способен образовывать реакции с большинством металлов. Однако, с благородными металлами, такими как золото, серебро и платина, реакции происходят в гораздо меньшем количестве.
Серебро и золото, например, обладают высокой устойчивостью к окислению и не образуют стабильных оксидов при обычных условиях. Однако, на высоких температурах или при длительном воздействии кислорода, они могут образовывать оксиды с соответствующими формулами Ag2O и Au2O3.
Платина может реагировать с кислородом при высоких температурах, образуя оксид PtO2. Этот оксид является хорошим катализатором в различных химических реакциях.
Также, благородные металлы могут быть защищены от действия кислорода покрытием из специальных материалов, таких как золото или платина, которые образуют стабильные оксиды, препятствующие дальнейшим окислительным процессам.
Стоит отметить, что благородные металлы широко используются в ювелирной и промышленной отраслях, благодаря их уникальным физическим и химическим свойствам, которые делают их столь ценными и востребованными материалами.
Возможные реакции кислорода с другими металлами:
Кислород – один из самых распространенных элементов в природе. Взаимодействие кислорода с металлами может приводить к окислению металла и образованию оксидов. Оксиды обычно характеризуются твердым состоянием и различными физическими и химическими свойствами.
Реакция кислорода с щелочными металлами, такими как натрий и калий, протекает очень быстро. Кислород окисляет щелочные металлы, образуя соответствующие оксиды. Например, натрий при взаимодействии с кислородом образует оксид натрия (Na2O), а калий – оксид калия (K2O).
Взаимодействие кислорода с щелочноземельными металлами, такими как магний и кальций, также приводит к образованию оксидов. Например, магний при реакции с кислородом образует оксид магния (MgO), а кальций – оксид кальция (CaO). Эти оксиды являются твердыми веществами и широко используются в промышленности.
Некоторые металлы, такие как алюминий и железо, могут образовывать различные оксиды в зависимости от условий реакции. Например, при взаимодействии кислорода с алюминием при высоких температурах образуется оксид алюминия (Al2O3). Алюминий также может образовывать оксиды с различной степенью окисления, например, AlO и Al2O.
Реакция кислорода с железом приводит к образованию двух основных оксидов – оксида железа (Fe2O3), который имеет красный цвет и называется железной рудой, и оксида железа (Fe3O4), который называется магнетитом и имеет черный цвет.
Вопрос-ответ

Какие есть металлы, с которыми кислород не реагирует?
Существуют металлы, которые не реагируют с кислородом. К ним относятся такие элементы, как золото и платина.
Реагирует ли кислород с алюминием?
Да, кислород реагирует с алюминием, но только при достаточно высоких температурах. В результате реакции образуется оксид алюминия (Al2O3).
Что происходит при реакции кислорода с железом?
При реакции кислорода с железом образуется оксид железа (Fe2O3), который обычно называется ржавчиной.
Какие реакции возникают при взаимодействии кислорода с щелочными металлами?
При взаимодействии кислорода с щелочными металлами, например, натрием или калием, образуется соответствующий оксид металла. Например, натрий реагирует с кислородом, образуя оксид натрия (Na2O).
Что получается в результате реакции кислорода с алюминием и медью?
Реакция кислорода с алюминием приводит к образованию оксида алюминия (Al2O3), а реакция кислорода с медью приводит к образованию оксида меди (CuO).
