Металлы являются одним из основных строительных материалов и необходимы для создания множества различных изделий. Исторически первым способом получения металлов было использование природных ресурсов, таких как руды и россыпи. Однако в современном мире эти природные источники не всегда способны удовлетворить потребности промышленности, поэтому были разработаны общие способы получения металлов.
Один из таких способов - электролиз. Он основан на использовании электричества для разложения химических соединений и получения чистых металлов. Электролиз применяется для получения алюминия, цинка, свинца и других металлов. Уравнения процессов электролиза очень важны для понимания химических реакций, происходящих в процессе.
Еще одним общим способом получения металлов является пирометаллургический метод. Он основан на использовании высоких температур и позволяет получать металлы из рудного сырья. Например, при пирометаллургическом способе получают медь и железо. Уравнения реакций, происходящих во время пирометаллургического процесса, помогают определить состав продуктов и обеспечивают контроль над процессом получения металлов.
Уравнения химических реакций

Уравнения химических реакций являются основным инструментом химического анализа и позволяют описывать протекающие процессы на уровне молекул и атомов. В химии уравнение химической реакции записывается в виде выражения, в котором указываются реагенты (исходные вещества) и продукты (образующиеся вещества), а также коэффициенты, отражающие стехиометрию реакции - соотношение количества веществ, участвующих в реакции.
Уравнение химической реакции должно быть сбалансировано, то есть количество атомов каждого элемента должно быть одинаковым на обеих сторонах уравнения. Для достижения баланса в уравнении используются коэффициенты перед формулами веществ. Коэффициенты указывают, в каком соотношении реагенты вступают в химическую реакцию и образуют продукты.
Уравнения химических реакций полезны для понимания, какие химические превращения происходят в реакционной смеси и какие вещества образуются в результате. Они также помогают определить степень окисления атомов в химических соединениях и дать количественное описание энергетических переходов и изменений состояния веществ в процессе реакции.
Примеры уравнений химических реакций включают реакцию синтеза (A + B → AB), реакцию разложения (AB → A + B), реакцию замещения (A + BC → AC + B), реакцию двойного разложения (AB + CD → AD + BC) и многие другие. Уравнения химических реакций также позволяют расчеты и оценку количества веществ, которые будут потребованы или образованы в реакции.)
Методы получения металлов

Металлы могут быть получены различными способами. Одним из основных методов получения металлов является использование руд. Руды содержат металлы в связанном состоянии и требуют специальной обработки для извлечения ценных металлических элементов. Для этого применяют различные процессы, такие как промывка, флотация, обжиг и дробление. В результате этих операций получается концентрат, из которого извлекают металлы с помощью химических или электролитических методов.
Кроме использования руд, металлы могут быть получены из отходов производства. В процессе производства различных продуктов накапливаются отходы, которые содержат различные металлы. Эти отходы могут быть подвергнуты обработке и переработке, чтобы извлечь ценные металлы. Например, железо можно получить из стали, алюминий - из отходов производства алюминиевых изделий.
Также одним из способов получения металлов является электролиз. Это процесс, при котором металлы извлекаются из электролитического раствора или плавящегося солевого состояния. При электролизе происходит разложение вещества под воздействием постоянного электрического тока, и в результате получается чистый металл. Этот метод получения металлов широко используется в промышленности.
Еще одним методом получения металлов является использование реакции металлов с кислородом. Некоторые металлы, такие как алюминий и цинк, очень реакционны и образуют оксиды при взаимодействии с кислородом. Эти оксиды могут быть подвергнуты обработке и превращены в металлы. Например, оксид алюминия может быть превращен в алюминий с помощью процесса электролиза.
Электролиз растворов солей металлов

Электролиз растворов солей металлов – один из общих способов получения металлов. В процессе электролиза раствора соли металла происходит разложение соли под воздействием постоянного электрического тока и образование металла на катоде.
Для проведения электролиза необходимо использовать противоположно заряженные электроды – анод и катод. Анод представляет собой положительно заряженный электрод, на который перемещаются отрицательные ионы соли металла. Катод – это отрицательно заряженный электрод, на котором осаждается металл.
Важными параметрами электролиза являются плотность тока и время его воздействия. Плотность тока определяется отношением силы тока к площади катода. Также важно учитывать концентрацию соли в растворе и выбор растворителя, так как это может влиять на образование и чистоту металлического осадка.
Электролиз растворов солей металлов широко применяется в промышленности для получения различных металлов, таких как алюминий, никель, медь и др. Кроме того, электролиз растворов солей металлов имеет большое значение в научных исследованиях и экспериментах в области электрохимии и металлургии.
Извлечение металлов из руд

Металлы являются важными материалами, используемыми в различных отраслях промышленности и технологии. Большинство металлов существуют в виде руд, которые содержат металлические элементы в сочетании с другими веществами. Для получения металлов из руд применяются различные общие способы обогащения и металлургические процессы.
Один из основных способов извлечения металлов из руд - это физическое разделение и обогащение. Первоначально руды подвергаются дроблению и помолу. Затем проводят флотацию или гравитационное разделение, чтобы разделить железистые и нежелезистые минералы. После этого, прохождение материала через магнитные, электрические или гравитационные поля позволяет извлекать металлы в их чистом виде.
Другой распространенный способ - это гидрометаллургические процессы. В этих процессах руды высоким давлением и температурой подвергаются обработке в присутствии кислот, щелочей или растворителей. Это позволяет разрушить химические связи между металлическими элементами и другими веществами, что облегчает их отделение и извлечение. Подобным образом, в некоторых случаях металлы могут быть извлечены с использованием электролиза, который основан на использовании электрического тока для отделения металлических ионов от остальных веществ.
Кроме того, существуют и другие способы получения металлов из руд, такие как пирометаллургические и химические процессы, которые включают обжиг и фрикционное анодное получение.
Общие способы получения металлов из руд включают комбинацию различных этапов и методов обогащения и переработки. Важно отметить, что каждая руда имеет свои особенности и требует индивидуального подхода для эффективного извлечения металлов.
Термическое восстановление металлов

Термическое восстановление металлов является одним из общих способов получения металлов. Этот процесс основан на применении высоких температур для восстановления металлических соединений в их элементарные формы.
Для термического восстановления металлов используются различные методы и реакции. Например, одним из распространенных методов является карботермическое восстановление, когда металлические оксиды реагируют с углеродом при высоких температурах.
Также существует метод восстановления металлических соединений с использованием реакции с металлами-редукторами. В этом случае реагентом, восстанавливающим металл, выступает другой металл, который обладает большей активностью. Этот метод широко применяется для получения железа и алюминия.
Термическое восстановление металлов имеет свои преимущества и недостатки. Среди преимуществ можно выделить высокую эффективность процесса и возможность получения металлов с высокой чистотой. Однако, данный метод требует больших затрат энергии и особых условий для проведения.
В целом, термическое восстановление металлов является важным и широко применяемым способом получения металлов. Благодаря этому процессу мы можем получить различные металлы, которые имеют большое значение в нашей жизни и промышленности.
Уравнения гидрохимических реакций
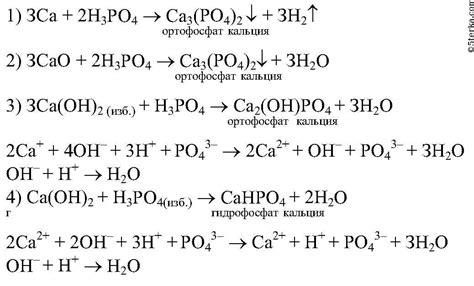
Гидрохимические реакции - это реакции, в которых протекает взаимодействие различных веществ с водой. В результате таких реакций могут образовываться различные соединения, включая металлы.
К примеру, одним из общих способов получения металлов является электролиз. В случае реакции с водой, уравнение такой реакции может быть записано следующим образом:
2H2O + 2e- → H2 + 2OH-
В данной реакции происходит расщепление молекулы воды под воздействием электрического тока, что позволяет получить водород и гидроксидное ион.
Кроме того, некоторые металлы могут взаимодействовать с водой, образуя гидроксиды. Так, уравнение реакции между натрием и водой может быть записано следующим образом:
2Na + 2H2O → 2NaOH + H2
Эта реакция протекает с выделением водорода и образованием гидроксида натрия.
Таким образом, гидрохимические реакции позволяют получать металлы из различных соединений, взаимодействуя с водой. Уравнения этих реакций позволяют описать процесс и определить образующиеся соединения.
Процесс гальванизации

Гальванизация является одним из общих способов получения металлов. Этот процесс основан на покрытии поверхности металла защитным слоем другого металла. Цель гальванизации заключается в создании защитного покрытия для увеличения стойкости металла к коррозии и повышения его эстетических свойств.
Процесс гальванизации осуществляется путем электрохимической реакции между анодом (металлом, который будет покрываться) и катодом (металлом, на который будет осуществлено покрытие). В этом процессе важную роль играет электролит, который обеспечивает проводимость электрического тока и содержит растворенные соли, необходимые для формирования покрытия.
Гальванизация применяется в различных отраслях промышленности, включая металлообработку, автомобильную промышленность, электронику и многие другие. Основные методы гальванизации включают электролитическую гальванизацию, гальваническое спекание и кадмиевое покрытие.
Преимущества гальванизации включают увеличение срока службы металлических изделий, усиление их механических свойств, а также улучшение их эстетических характеристик. Кроме того, гальванизация обеспечивает защиту от коррозии, что особенно важно в условиях повышенной влажности или агрессивной химической среды.
Окислительно-восстановительные реакции
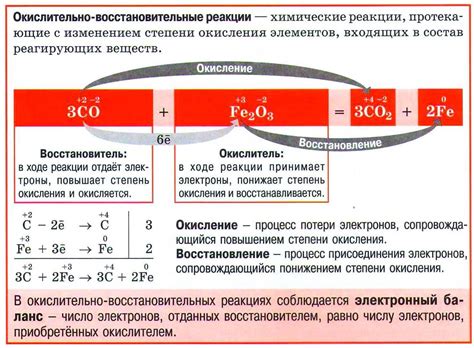
Окислительно-восстановительные (окислительно-восстановительные) реакции - это химические превращения, при которых происходит перенос электронов от одного вещества к другому. В таких реакциях одно вещество, называемое окислителем, получает электроны и восстанавливается, а другое вещество, называемое восстановителем, отдает электроны и окисляется.
Окислительно-восстановительные реакции являются основой многих промышленных и химических процессов, включая получение металлов. Именно в таких реакциях металлы окисляются и превращаются в ионы, которые затем могут быть восстановлены и получены в виде чистого металла.
Часто в окислительно-восстановительных реакциях используются специальные вещества, называемые окислителями и восстановителями. Например, при получении алюминия из его оксида используется вещество, способное отдать электроны и восстановить алюминий – это натрий. Оксид алюминия в данном случае является окислителем, а натрий – восстановителем.
Для проведения окислительно-восстановительных реакций необходимо соблюдать ряд условий, таких как наличие электролита (вещества, в котором могут двигаться ионы), проводящих материалов и среды, которая предотвращает разрушение и коррозию оборудования. Кроме того, необходимо контролировать температуру и давление, чтобы обеспечить оптимальные условия реакции.
Окислительно-восстановительные реакции имеют широкое применение в различных областях, от получения металлов до производства электроэнергии. Они являются важным инструментом в химии и позволяют осуществлять множество технологических процессов с высокой эффективностью.
Вопрос-ответ

Какие существуют общие способы получения металлов?
Существуют различные общие способы получения металлов, включая электролиз, термическую обработку и химические методы.
Какой общий способ получения металлов является наиболее распространенным?
Наиболее распространенным общим способом получения металлов является термическая обработка, осуществляемая путем нагревания и последующего охлаждения руды или сплава.
Каким образом можно получить металлы с помощью электролиза?
Метод электролиза основан на процессе разложения вещества при пропускании электрического тока через него. Через электролит проходят положительно заряженные и отрицательно заряженные ионы, образуя металл на катоде, а освобождающиеся отрицательно заряженные ионы переносятся на анод и аннигилируют.
