Взаимодействие металлов с солью представляет собой химический процесс, в результате которого происходят различные реакции. Это связано с тем, что металлы являются активными элементами, которые могут вступать в реакцию с другими веществами, включая соли.
Одним из основных типов реакций между металлом и солью является обмен. В ходе обменной реакции ионы одного металла замещают ионы другого металла в соли. Например, когда вода взаимодействует с медью(II) сульфатом, ионы меди замещают ионы водорода, образуя медную соль и освобождая молекулы воды.
CuSO4 + H2O → Cu(OH)2 + H2SO4
Другой тип реакции - окислительно-восстановительная реакция. В ходе этой реакции один металл окисляется, а другой восстанавливается. Например, когда медь взаимодействует с серной кислотой, медь окисляется, а серная кислота восстанавливается, образуя сернокислую медь и выделяя молекулы воды и диоксид серы.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Понимание уравнений взаимодействия металлов с солью позволяет лучше понять химические процессы, происходящие в природе и в промышленности. Знание этих реакций имеет большое значение для различных областей науки и технологии, таких как металлургия, электрохимия и современные материалы.
Металлы и соли: основная информация
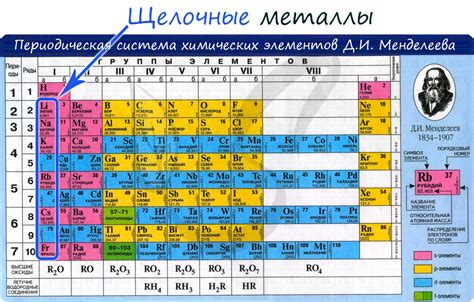
Металлы - это химические элементы, обладающие свойством проводить электрический ток и обладающие блестящей поверхностью. Металлы часто используются в различных отраслях промышленности, таких как машиностроение, электроника и строительство.
Соли - это химические соединения, состоящие из положительно заряженного ионного гда атом металла или другое металлоидного элемента, и аниона - отрицательно заряженного ионного радикала кислоты или оксида. Соли имеют широкое применение в различных областях, включая пищевую промышленность, медицину и химическую промышленность.
Уравнение взаимодействия металлов с солью - описывает химическую реакцию между металлом и солью. При реакции между металлом и солью происходит обмен ионами, что ведет к образованию новых соединений. Реакция может протекать с выделением газов, образованием осадка или изменением цвета реакционной смеси.
Значение уравнения взаимодействия металлов с солью - важно для понимания химических свойств и реактивности металлов. Знание уравнения взаимодействия позволяет предугадывать и контролировать протекание реакций, а также использовать металлы и соли в различных процессах и технологиях. Это имеет большое значение в различных научных, промышленных и медицинских областях.
Взаимодействие металлов и солей: процессы и физические явления

Взаимодействие металлов и солей является процессом, в результате которого происходят химические реакции между металлическими элементами и соединениями солей. Эти реакции могут происходить как в водных растворах, так и на поверхности металлов.
Одним из типичных явлений, происходящих при взаимодействии металлов и солей, является процесс образования осадка. При введении раствора соли к металлу может произойти реакция, в результате которой на поверхности металла образуется твердый осадок. Это связано с образованием новых соединений между ионами металла и ионами соли.
Кроме того, при взаимодействии металлов и солей может происходить процесс окисления-восстановления. Например, металл может выступать в роли восстановителя и передавать электроны ионам металла в растворе соли. Это может привести к изменению состояния ионов и образованию новых веществ.
Также важно отметить, что при взаимодействии металлов и солей может происходить процесс образования газов. Например, при добавлении металла к раствору соли может возникнуть химическая реакция, в результате которой выделяется газ. Это связано с образованием газообразных соединений между ионами металла и ионами соли.
В итоге, взаимодействие металлов и солей является сложным процессом, который включает множество химических реакций и физических явлений. Эти процессы могут приводить к образованию осадков, окислению-восстановлению и выделению газов. Изучение этих явлений позволяет получить более полное представление о взаимодействии металлов и солей и их значения в химии.
Уравнение химической реакции металлов с солью
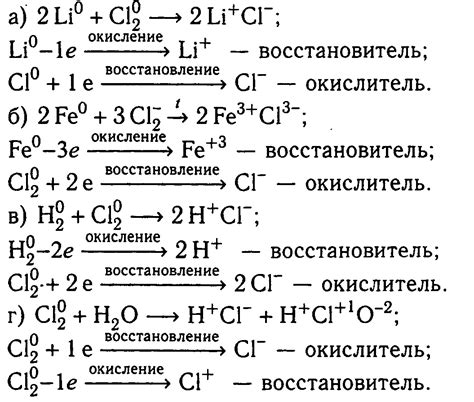
Уравнение химической реакции металлов с солью описывает процесс взаимодействия металла с солью и образования новых веществ. В реакции участвуют металл и соль, которая представляет собой соединение металла с кислотой.
Уравнение реакции можно записать следующим образом:
М + Соль → Металлическая соль + Газ
Где М - металл, Соль - соединение металла с кислотой, Металлическая соль - новое соединение, образовавшееся в результате реакции, Газ - побочный продукт реакции.
В ходе реакции металл отдает электроны и окисляется, а ионы металла в соли принимают электроны и восстанавливаются. Это приводит к образованию металлической соли и выделению газа.
Уравнения реакций зависят от конкретных металлов и солей, поэтому для каждой пары металл-соль будет свое уравнение реакции. Например, уравнение реакции алюминия с хлоридом натрия будет выглядеть следующим образом:
| Алюминий | + | Хлорид натрия | → | Алюминиевый хлорид | + | Газ |
|---|---|---|---|---|---|---|
| Al | + | NaCl | → | AlCl3 | + | H2 |
В данной реакции алюминий и хлорид натрия реагируют между собой, образуя алюминиевый хлорид и выделяя газ - водород.
Уравнение химической реакции металлов с солью является основой для понимания процессов производства и применения различных металлических соединений и их роли в различных областях науки и промышленности.
Реакции разложения металлов при взаимодействии с солью

Реакция разложения металлов при взаимодействии с солью является одним из основных процессов в химии. Металлы вступают в химическую реакцию с солью, образуя новые вещества и высвобождая газы.
При взаимодействии с кислотными солями, металлы образуют соль и выделяются водород. Например, реакция разложения цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2
Также при реакции металлов с солью может происходить выделение специфических газов. Например, при взаимодействии железа с соляной кислотой образуется соль хлорида железа и выделяется хлор:
Fe + 2HCl = FeCl2 + H2
2Fe + 6HCl = 2FeCl3 + 3H2
Также возможна реакция разложения металлов с солью при взаимодействии с щелочными растворами. Например, реакция разложения алюминия с гидроксидом натрия:
2Al + 2NaOH + 6H2O = 2NaAl(OH)4 + 3H2
Реакции разложения металлов при взаимодействии с солью имеют большое значение в промышленности, а также в лаборатории для получения нужных веществ.
Химические свойства продуктов реакции металлов с солью
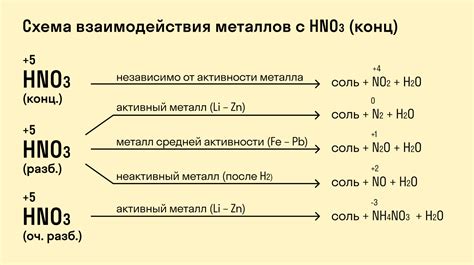
Реакция металлов с солью приводит к образованию различных продуктов, которые обладают своими химическими свойствами. В зависимости от металла и соли, образующиеся соединения могут быть различными и иметь различные химические свойства.
Одним из возможных продуктов реакции металла с солью может быть образование осадка. Это нерастворимое вещество, которое выпадает из раствора в виде мелких частиц. Осадок может быть разного цвета и состава в зависимости от металла и соли. Например, при реакции меди с раствором серебряной соли образуется осадок красноватого цвета.
Кроме образования осадков, реакция металлов с солью может приводить к изменению окраски раствора. Некоторые металлы обладают способностью изменять окраску раствора соли. Например, при реакции железа с раствором медной соли происходит изменение цвета раствора с голубого на зеленый. Это связано с образованием новых химических соединений, которые имеют разные оптические свойства.
Другим продуктом реакции металлов с солью может быть выделение газа. Некоторые металлы обладают способностью взаимодействовать с солью таким образом, что при реакции выделяется газ. Например, при взаимодействии алюминия с раствором соли соляной кислоты наблюдается выделение газового вещества - водорода. Это свидетельствует о том, что происходит химическая реакция и образуется новое вещество - вода.
Значение уравнения взаимодействия металлов с солью в промышленности

Уравнение взаимодействия металлов с солью имеет огромное значение в промышленности. Это уравнение позволяет определить, какие металлы могут реагировать с определенными солями и какие химические реакции происходят в результате этого взаимодействия.
Одним из важных примеров использования уравнения взаимодействия металлов с солью является гальваническая коррозия. При этом процессе металлы реагируют с солью, что приводит к разрушению поверхности металла. Знание уравнения взаимодействия металлов с солью позволяет предотвратить коррозию, применяя различные защитные покрытия или используя технику анодной и катодной защиты.
Кроме того, уравнение взаимодействия металлов с солью используется для получения металлов из рудных сырьевых материалов. Например, при переработке руд содержащих медь, применяют электролиз, в результате которого медь осаждается на катоде. Уравнение взаимодействия металлов с солью позволяет рассчитать эффективность процесса и определить оптимальные условия его проведения.
Также уравнение взаимодействия металлов с солью имеет применение в процессе покрытия металлов. Например, гальваническое покрытие используется для придания металлическим изделиям декоративного вида, защиты от коррозии и улучшения функциональных свойств. Уравнение взаимодействия металлов с солью позволяет выбрать правильную соль и определить условия проведения процесса покрытия для достижения желаемых результатов.
Практическое применение уравнения взаимодействия металлов с солью

Уравнение взаимодействия металлов с солью находит свое практическое применение в различных областях химии и техники. С помощью этого уравнения можно прогнозировать химические реакции и определять возможность взаимодействия металлов с солями.
Одним из важных практических применений этого уравнения является процесс гальванизации. Гальванизация - это метод покрытия металлических поверхностей слоем другого металла. При помощи уравнения взаимодействия металлов с солью можно определить, какой металл лучше всего подходит для покрытия данной поверхности и какая соль будет использована в процессе.
Также уравнение взаимодействия металлов с солью имеет применение при проведении электрохимических реакций. Например, в батарейках и аккумуляторах используются различные металлы и соли, между которыми происходит электрохимическая реакция. Уравнение позволяет определить, какой металл и какая соль будут эффективнее в данной системе.
Кроме того, уравнение взаимодействия металлов с солью находит применение в процессе обработки и очистки воды. Например, при удалении ртути из воды используется процесс обмена ионами, и с помощью уравнения можно подобрать оптимальный металлический материал и соль для этой задачи.
Итак, уравнение взаимодействия металлов с солью играет важную роль в различных областях науки и техники. Оно позволяет проводить прогнозы и оптимизировать химические реакции, а также находить практическое применение в создании новых материалов и технологий.
Уравнение взаимодействия металлов с солью в научных исследованиях

Изучение уравнения взаимодействия металлов с солью является важным предметом научных исследований в области химии. Это позволяет понять, как происходят химические реакции между металлическими элементами и солями.
Уравнение взаимодействия металлов с солью выражает химическую реакцию между металлическим элементом и соответствующей солью. Оно позволяет определить химический состав продуктов реакции и выявить основные фазы протекающих процессов. На основе уравнений взаимодействия металлов с солью можно сделать выводы о степени растворимости соли, образующихся осадков и изменениях в электрохимическом потенциале металла.
Научные исследования по уравнению взаимодействия металлов с солью позволяют определить термодинамические и кинетические параметры реакции. Это позволяет оценить эффективность химической реакции и возможность использования данной системы для различных приложений, таких как каталитические процессы, электролиз и другие технологии.
В ходе исследований уравнения взаимодействия металлов с солью часто используется методика проведения электроанализа, спектроскопии, электрохимических измерений и других физико-химических методов. Они позволяют получить количественные данные о реакции, определить константы равновесия и скорости реакции, а также изучить механизмы происходящих процессов.
Вопрос-ответ

Какие химические реакции происходят при взаимодействии металлов с солью?
При взаимодействии металлов с солью могут происходить различные химические реакции, в зависимости от свойств металла и соли. Например, металл может образовать ион, который реагирует с ионами соли, образуя осадок или выпадая в виде осадка. Также возможна реакция окисления-восстановления, при которой металл окисляется, а ион из соли восстанавливается. В обоих случаях происходят изменения состава и структуры веществ, что может иметь различные значения и применения в химии и технологии.
Какие осадки образуются при взаимодействии металлов с солью?
При взаимодействии металлов с солью могут образовываться различные осадки. Например, при взаимодействии цинка с раствором серной кислоты образуется белый осадок серы. При взаимодействии железа с раствором серной кислоты образуется зеленый осадок железной соли. При взаимодействии меди с раствором серной кислоты образуется синий осадок меди. Такие осадки могут иметь различные значения и использоваться в аналитической химии для определения наличия и количества определенных ионов в растворе.
Какие реакции окисления-восстановления происходят при взаимодействии металлов с солью?
При взаимодействии металлов с солью могут происходить реакции окисления и восстановления. Например, при взаимодействии цинка с раствором медного(II)сульфата ион меди восстанавливается до нулевой степени окисления, а цинк окисляется до ионов цинка(II). При этом выделяется энергия в виде тепла. Такие реакции имеют важное значение в химии и электрохимии, так как способствуют преобразованию энергии и могут использоваться в гальванических элементах и аккумуляторах.
