Водород – самый легкий химический элемент в самом верхнем углу периодической системы Менделеева. В своем естественном состоянии водород существует в виде двухатомных молекул, H₂. Однако в присутствии некоторых металлов, особенно очень активных, водород может проявлять высокую химическую активность и образовывать различные соединения.
Одним из наиболее известных примеров таких реакций является взаимодействие водорода с металлом натрием (Na). Уравнение этой реакции можно записать следующим образом: 2Na + H₂ → 2NaH. В результате этой реакции образуется соединение натрия с водородом, натриевый гидрид (NaH).
Ключевой особенностью данной реакции является высокая активность металла натрия, которая проявляется в способности активно вступать в химические реакции с другими веществами. В реакции с водородом натрий выступает в качестве окислителя, принимая электроны от водорода и превращаясь из нейтрального атома в ион натрия, Na⁺. Водород же, в свою очередь, отдает свои электроны и превращается из нейтральных молекул в ионы водорода, H⁻.
Свойства водорода и его реакция с активными металлами
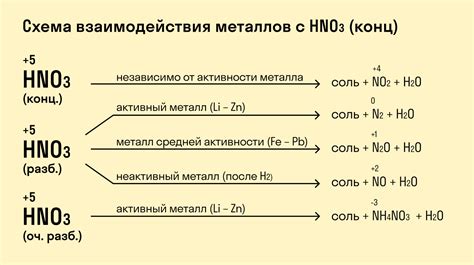
Водород - химический элемент с атомным номером 1 и наименьшей атомной массой. Это самый легкий элемент в периодической системе, обладающий уникальными свойствами. Один из ключевых аспектов водорода - его возможность реагировать с различными другими веществами и элементами.
Очень активные металлы, такие как литий (Li), натрий (Na) и калий (K), способны вступать в реакцию с водородом. Реакция водорода с активными металлами происходит с выделением большого количества тепла и образованием гидридов металлов.
Уравнение реакции водорода с металлами может быть представлено следующим образом:
2M + H2 → 2MH,
где M представляет собой активный металл.
Реакция водорода с активными металлами обычно происходит при комнатной температуре и в нормальных условиях. Например, литий может образовать гидрид LiH, натрий - NaH, а калий - KH. Гидриды металлов обычно обладают отличными от своих компонентов свойствами, такими как высокая реакционная способность и хорошая проводимость для электричества и тепла.
Реакция водорода с активными металлами имеет практическое применение, например, в процессах химического синтеза, водородной энергетике и производстве сплавов. Понимание химических свойств водорода и его реакции с активными металлами имеет большое значение для различных областей науки и технологии.
Взаимодействие водорода с натрием
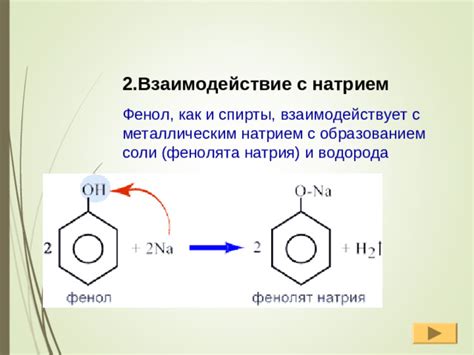
Водородный натрий – смесь водорода и натрия – является химическим соединением, которое образуется при взаимодействии водорода с очень активным металлом натрием.
Взаимодействие водорода с натрием происходит с выделением большого количества энергии в виде тепла и света. Реакция протекает сильно экзотермически. Водородное натрия образуется в виде яркого оранжевого пламени и выделяется в виде пузырьков.
Уравнение реакции:
- 2Na + H2 -> 2NaH
Полученное вещество – натриевый гидрид – представляет собой сплав, который обладает металлическими свойствами. Натрий в натриевом гидриде проявляет характерные ионные свойства.
Водородные соединения натрия, такие как натриевый гидрид, широко используются в химической промышленности для различных процессов и реакций, а также в качестве химических реагентов.
Активность натрия
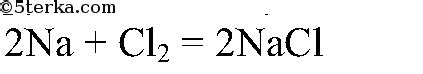
Натрий является очень активным металлом, который реагирует с водородом, образуя щелочную соль и выделяя водородный газ. Уравнение этой реакции выглядит следующим образом:
2Na + 2H2O → 2NaOH + H2
Реакция между натрием и водой происходит с выделением большого количества тепла и обычно происходит с ярким пламенем. В результате этой реакции образуется щелочь натрия (натриевая гидроксид) и водородный газ, который можно собрать и использовать в качестве топлива или индикатора реакций.
Натрий - металл серебристо-белого цвета, который легко реагирует с влажным воздухом, поэтому хранится под слоем масла или в инертной среде. Его активность объясняется наличием одной внешней электронной оболочки, которая легко отдаётся, образуя ион натрия с положительным зарядом. Поэтому натрий активно реагирует с водой и другими веществами, обладающими высокой электроотрицательностью.
Во время реакции натрий исчезает из реакционной смеси, а в итоге образуется щелочь и водород. Кроме того, водородный газ, который образуется в результате этой реакции, обладает высокой поражающей способностью и может образовывать горючие смеси с воздухом. Поэтому манипулировать натрием и проводить реакции с ним нужно с осторожностью и с соблюдением всех мер предосторожности.
Уравнение реакции

Реакция водорода с очень активными металлами является одним из классических примеров реакции с простейшим газом. Уравнение этой реакции может быть записано следующим образом:
Металл + водород → металлический гидрид
При этом водород вступает в реакцию с металлом, образуя металлический гидрид. В результате процесса образуется соединение, в котором водород является анионом, а металл катионом.
Уравнение реакции может быть представлено более детально, указывая конкретные металлы и продукты реакции. Например, реакция водорода с натрием:
- 2Na + H2 → 2NaH
В данном случае две молекулы натрия реагируют с одной молекулой водорода, образуя две молекулы натриевого гидрида.
Уравнение реакции водорода с очень активными металлами позволяет увидеть процесс взаимодействия между газообразным элементом и металлом, и является важным фундаментальным примером в химии.
Взаимодействие водорода с калием
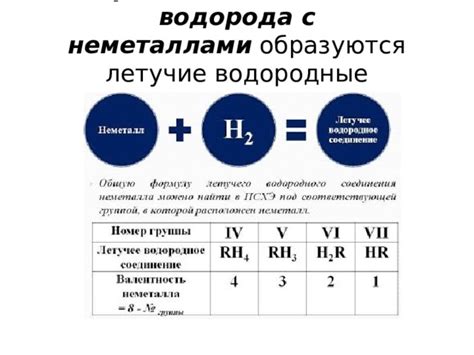
Водород и калий являются очень активными элементами, поэтому их соединение может протекать достаточно интенсивно и нестабильно.
При взаимодействии водорода с калием образуется гидрид калия, представленный в виде соединения KH. Это вещество представляет собой бесцветные кристаллы, которые обладают сильным щелочным свойством.
Взаимодействие происходит следующей реакцией:
2K + H2 → 2KH
Реакция сопровождается выделением большого количества тепла и образованием водорода. Образующийся гидрид калия растворяется в воде, что приводит к образованию водородной кислоты.
Реакция взаимодействия водорода с калием протекает взрывоопасно и под увеличенным давлением, поэтому требуется соблюдение особых мер предосторожности при проведении таких экспериментов.
Активность калия
Калий является одним из наиболее активных металлов в химии. Он относится к первой группе периодической системы элементов и имеет атомный номер 19. Калий обладает мягкой и серебристо-белой металлической структурой.
Активность калия проявляется в его способности быстро реагировать с водой. При контакте с водой калий выделяет большое количество водорода, что приводит к образованию щелочной среды. Цвет воды в результате реакции становится ярко-фиолетовым.
Величина активности металлов определяется их энергией ионизации и аффинностью к электрону. Калий имеет низкую энергию ионизации и высокую аффинность к электронам, что делает его очень активным металлом.
Важно отметить, что активность калия может привести к опасным последствиям при неправильном обращении с ним. Калий реагирует с кислородом и влажным воздухом, а также может вызывать ожоги при попадании на кожу или слизистую оболочку.
Общая химическая реакция между калием и водой выражается следующим уравнением:
2 K + 2 H2O → 2 KOH + H2
Уравнение реакции

Уравнение реакции водорода с очень активными металлами можно записать в следующем виде:
H2 + M → MH2
Где H2 обозначает молекулу водорода, а M - очень активный металл, например, натрий, калий или литий.
Это уравнение показывает, что в результате реакции водород образует бинарное соединение с металлом, при этом каждый атом металла связывается с двумя атомами водорода.
В процессе реакции положительно заряженные ионы металла образуются благодаря передаче электронов от водорода к металлу. Таким образом, водород окисляется, а металл восстанавливается.
Реакция водорода с очень активными металлами происходит с выделением тепла и образованием гидридов металлов. Гидриды металлов обладают высокой реактивностью и способностью взаимодействовать с другими веществами.
Взаимодействие водорода с литием

Литий – один из наиболее активных металлов, с которым водород образует химическое соединение. Величина энтальпии реакции между водородом и литием положительная и составляет около 90 кДж/моль. Однако, несмотря на образование энергетически выгодного соединения, реакция протекает очень медленно. Это объясняется высокой степенью пассивности лития к взаимодействию с водородом.
В ходе реакции водород с литием образует вещество, называемое гидридом лития (LiH). Это белый кристаллический порошок, не растворимый в воде. Гидрид лития является сильным основанием и реагирует с кислотами, образуя соль и выделяя водородный газ.
Реакция водорода с литием может протекать при нагревании или при использовании катализаторов, таких как никель или платина. Однако, в любом случае она требует дополнительной энергии для преодоления пассивности металла.
Водород-литиевые системы широко используются в реактивных двигателях и батареях, так как гидрид лития обладает высокой объемной энергией и относительно низкими температурами реакции. Однако, применение таких систем ограничено сложностью контроля реакции и возможностью взрыва в случае неконтролируемого контакта с воздухом или водой.
Активность лития
Литий является наиболее активным металлом в группе щелочных металлов. Он обладает одной из самых высоких степеней химической активности среди всех элементов.
Литий реагирует с водой, причем реакция происходит очень интенсивно. В результате взаимодействия лития с водой образуется гидроксид лития (LiOH) и выделяется водородный газ (H2).
Активность лития можно объяснить его структурой и положением в периодической системе. Литий имеет электронную конфигурацию [He]2s1. У него всего один электрон в валентной оболочке, и он легко отдает его при реакции с другими веществами, в том числе с водой.
Кроме того, литий очень низкой плотности и малой массы, что позволяет ему образовывать легкие соединения. Это свойство лития нашло применение в создании легких аккумуляторов и литий-ионных батарей.
Таким образом, активность лития проявляется в его способности реагировать с водой, образуя гидроксид и выделяя водородный газ. Это обусловлено его электронной конфигурацией и низкой плотностью. Знание об активности лития позволяет использовать его в различных технологиях и применениях, связанных с энергетикой и химической промышленностью.
Вопрос-ответ

Какая реакция происходит между водородом и активными металлами?
Реакция между водородом и активными металлами – это химическое взаимодействие, при котором водород присоединяется к металлу, образуя металлический гидрид.
Какими металлами происходит реакция с водородом?
Реакция с водородом происходит с очень активными металлами, такими как литий (Li), натрий (Na), калий (K), магний (Mg) и кальций (Ca).
Какие приложения имеют металлические гидриды, образующиеся в результате реакции водорода с активными металлами?
Металлические гидриды, полученные в результате реакции водорода с активными металлами, имеют широкий спектр применения. Они используются как съемные источники водорода для топливных элементов, водородных отопительных систем и портативных генераторов. Также металлические гидриды могут служить в качестве средств хранения водорода, используемого в различных индустриальных процессах.
