Уравнение реакций щелочных металлов с неметаллами является одной из основных тем в химии и химической реакции. Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), являются очень активными элементами и соединяются с различными неметаллами, образуя соли.
Принципы уравнения реакций щелочных металлов с неметаллами основаны на том, что щелочные металлы отдают свой внешний электрон, образуя катионы, а неметаллы принимают электрон, образуя анионы. Таким образом, происходит обмен электронами между щелочными металлами и неметаллами, что приводит к образованию ионных соединений.
Примером уравнения реакции щелочного металла с неметаллом может служить реакция натрия с хлором. В этой реакции натрий отдает свой внешний электрон, становясь положительно заряженным ионом, а хлор принимает этот электрон, становясь отрицательно заряженным ионом. Таким образом, образуются ионы натрия и ионы хлора, которые образуют ионную решетку хлорида натрия.
Уравнение реакций щелочных металлов с неметаллами имеет важное прикладное значение. Например, щелочные металлы используются в производстве различных химических соединений, таких как щелочные гидроксиды, соды, хлориды, и др. Эти соединения находят широкое применение в различных отраслях промышленности, а также в быту.
Основы уравнения реакций щелочных металлов с неметаллами

Реакции щелочных металлов с неметаллами являются важным предметом изучения в области химии. Щелочные металлы (натрий, калий, рубидий, цезий) имеют свойство образовывать ион положительного заряда в растворах и вступать в реакции с различными неметаллами.
Уравнение реакции между щелочным металлом и неметаллом позволяет определить состав и свойства образовавшейся соли. Для составления уравнения следует учитывать заряд ионов металла и неметалла, а также определить соотношение между ними.
В реакции щелочного металла с неметаллом образуется соль, которая может иметь различные свойства. Например, реакция натрия с хлором приводит к образованию соли – хлорида натрия, который является основной солью поваренной соли.
Уравнение реакции щелочных металлов с неметаллами также может служить основой для определения степени окисления атомов веществ. Расчет степени окисления позволяет определить тип реакции и свойства образующихся ионов.
Изучение уравнений реакций щелочных металлов с неметаллами позволяет лучше понять химические процессы, происходящие в природе и промышленности. Это позволяет использовать щелочные металлы и их соединения в различных областях, включая производство пищевых продуктов, энергетику, медицину и другие отрасли.
Принципы уравнения

Процесс уравнения реакций щелочных металлов с неметаллами основан на принципе сохранения массы. Уравнение реакции должно учитывать, что количество атомов каждого элемента до и после реакции должно быть одинаковым. Для облегчения этого процесса, существует ряд правил и принципов.
1. Вначале необходимо определить периодическую таблицу для определения заряда и количество атомов щелочного металла и неметалла.
2. Определите правило металл-неметалл и убедитесь, что это правило применимо к реакции, которую вы хотите уравнять. Например, щелочные металлы обычно реагируют с неметаллами, образуя ионные соединения.
3. Установите соотношение между атомами щелочного металла и неметалла в веществах до и после реакции. Например, если неметалл имеет заряд -2, а щелочный металл имеет заряд +1, то необходимо использовать два атома щелочного металла для реакции с одним атомом неметалла.
4. Проверьте, что сумма зарядов атомов веществ до реакции равна сумме зарядов атомов веществ после реакции. Если это не так, то уравнение нужно балансировать путем добавления коэффициентов перед формулами веществ.
Кроме того, при уравнении реакций щелочных металлов с неметаллами необходимо учитывать электронную конфигурацию атомов и применять правила октета, чтобы уравнять количество электронов в веществах до и после реакции.
Примеры реакций щелочных металлов с неметаллами
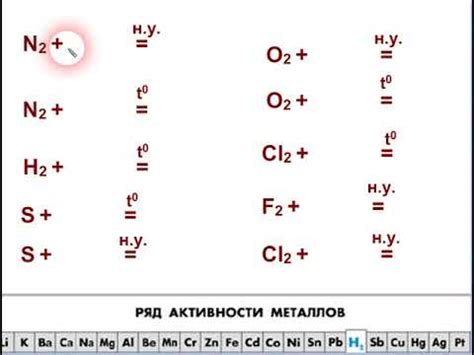
Щелочные металлы, такие как литий, натрий, калий, реагируют с неметаллами, образуя различные соединения. Реакции этих металлов с неметаллами являются энергичными и инициируются контактом металла с неметаллом.
Одним из наиболее известных примеров реакции щелочных металлов с неметаллами является реакция натрия с хлором. При контакте натрия с хлором образуется хлорид натрия (NaCl), который является обычной поваренной солью. Эта реакция проходит при нагревании и сопровождается выделением энергии и ярким свечением.
Другим примером реакции щелочных металлов с неметаллами является реакция калия с кислородом. При соединении калия с кислородом образуется оксид калия (K2O). Эта реакция проходит при высокой температуре и сопровождается интенсивным горением и выделением яркой вспышки.
Еще одним примером реакции щелочных металлов с неметаллами является реакция лития с серой. При соединении лития с серой образуется сульфид лития (Li2S). Эта реакция является энергичной и может происходить при комнатной температуре.
Таким образом, реакции щелочных металлов с неметаллами описывают процессы, в которых происходит образование новых соединений. Эти реакции имеют не только научное, но и практическое значение, так как многие полученные продукты широко используются в промышленности и повседневной жизни.
Вопрос-ответ

Какие металлы являются щелочными?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Что такое уравнение реакций щелочных металлов с неметаллами?
Уравнение реакций щелочных металлов с неметаллами описывает химическую реакцию, при которой щелочный металл соединяется с неметаллом и образуется соответствующее сложное вещество.
Какие принципы лежат в основе уравнения реакций щелочных металлов с неметаллами?
В основе уравнения реакций щелочных металлов с неметаллами лежат принципы сохранения массы (масса реагентов равна массе продуктов реакции) и сохранения заряда (общий заряд реагентов равен общему заряду продуктов реакции).
