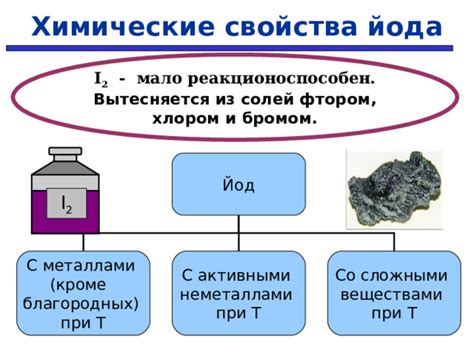
Реакция йода с металлами - это химический процесс, при котором йод вступает во взаимодействие с металлическими элементами. Уравнение таких реакций может выглядеть следующим образом:
2I2 + 2M → 2MI
Где I2 представляет молекулы йода, M – металл, а MI – ион металла в йодиде.
Особенностью реакции йода с металлами является образование йодидов металлов, которые обладают специфическими физическими и химическими свойствами. Йодиды металлов обычно представляют собой соли, растворимые в воде, характеризующиеся наличием ионов металла и йода.
Примером реакции йода с металлом может служить взаимодействие йода с алюминием:
2Al + 3I2 → 2AlI3
В результате этой реакции образуется йодид алюминия (AlI3), который является белым кристаллическим веществом, растворимым в органических растворителях.
Особенности и примеры уравнения реакции йода с металлами

Йод (I2) - это химический элемент из группы галогенов, который обладает высокой реакционной способностью. Он может подвергаться реакции с различными металлами, порождая интересные и важные химические превращения.
Уравнение реакции йода с металлами имеет свои особенности. Во-первых, при контакте с металлом йод обычно реагирует не непосредственно с поверхностью металла, а с образовавшимся окислом металла. Также, реакция может протекать медленно и требовать нагревания или наличие катализатора для инициирования процесса.
Примером уравнения реакции йода с металлами является реакция йода с железом (Fe). При нагревании йод и железо вступают в реакцию, образуя йодид железа (FeI2). Уравнение данной реакции можно записать следующим образом: I2 + 2Fe → 2FeI2.
Другим примером реакции йода с металлами является реакция йода с алюминием (Al). В результате этой реакции образуется йодид алюминия (AlI3). Уравнение данной реакции можно записать следующим образом: 2Al + 3I2 → 2AlI3.
Такие реакции йода с металлами могут быть использованы в химическом анализе для определения наличия или концентрации определенного металла в пробе. Они также имеют важное применение в органическом синтезе для получения йодированных органических соединений.
Важность понимания процессов окисления и восстановления

Окисление и восстановление являются фундаментальными химическими процессами, которые играют важную роль во многих аспектах нашей жизни. Понимание этих процессов позволяет нам объяснить, как происходят различные реакции в организмах, окружающей среде и технологических процессах.
Окисление - это процесс, в результате которого вещество теряет электроны, образуя положительно заряженные ионы или молекулы. Восстановление, напротив, представляет собой процесс приобретения электронов веществом и образование отрицательно заряженных ионов или молекул.
Важно понимать, что окисление и восстановление - взаимосвязанные процессы. Одна реакция не может произойти без другой. Во многих химических реакциях одно вещество окисляется, отдавая электроны, а другое вещество восстанавливается, получая электроны.
Данные процессы играют значительную роль в металлургии, электрохимии, биологии и других областях науки и промышленности. Например, процессы окисления и восстановления используются в электролизе для разделения соединений и получения металлов, в производстве батарей, в синтезе органических соединений и многих других технических и химических процессах.
В медицине и биологии окисление и восстановление играют важную роль в метаболических процессах организма, в борьбе с инфекциями и повреждениями клеток. Понимание этих процессов позволяет разрабатывать новые методы диагностики и лечения различных заболеваний.
Йод как окислитель и его взаимодействие с различными металлами

Йод (I2) – это химический элемент из группы галогенов, обладающий свойствами окислителя. Он способен вступать в реакции с различными металлами, образуя соли йода.
Йодный окислительный потенциал данного элемента позволяет ему окислять металлы, передавая им электроны. В результате происходит окислительно-восстановительная реакция, в которой йодное соединение принимает электроны от металла, превращая его в ион. В свою очередь, йод получает электроны от другого вещества, окисляясь до йодида.
Реакция между йодом и металлами может происходить как в растворе, так и в твердой фазе. В растворах металлы могут реагировать с йодом, образуя йодиды металлов, которые растворяются и образуют ионные соединения. В твердой фазе йод может образовывать фиолетовые кристаллы, которые взаимодействуют с металлами, образуя осаждения или сплавы.
Примерами взаимодействия йода с металлами являются реакции с железом, медью, алюминием, свинцом и другими элементами. Например, реакция между йодом и железом приводит к образованию йодида железа:
- Fe + I2 → FeI2
Реакции йода с металлами являются одним из способов получения йодидов металлов. Кроме того, эти реакции имеют широкое применение в различных областях химии и технологии, включая органическую синтез, производство лекарственных препаратов и фотографическую индустрию.
Уравнение реакции йода с щелочными металлами

Реакция йода с щелочными металлами, такими как натрий, калий и литий, проходит с образованием соответствующих йодидов металлов. Уравнения данных реакций имеют общий вид:
- 2Na + I2 → 2NaI
- 2K + I2 → 2KI
- 2Li + I2 → 2LiI
При соприкосновении металла щелочного металла с йодом происходит редокс-реакция, в результате которой два атома металла отдают два электрона, что приводит к образованию положительно заряженных ионов металла (Na+, K+, Li+), а йод молекулярного галогена принимает электроны и превращается в отрицательно заряженные йодид-ионы (I-). Полученные йодиды металлов обладают высокой растворимостью в воде и образуют белые или безцветные растворы или кристаллы.
Уравнение реакции йода с щелочными металлами является типичным примером реакции между металлом и неметаллом. Такие реакции широко используются в химических процессах производства, в научных исследованиях и в повседневной жизни. Они представляют значимый интерес для изучения свойств металлов и их взаимодействия с другими веществами.
Уравнение реакции йода с щелочноземельными металлами

Йод (I2) – химический элемент, который активно взаимодействует с металлами, включая щелочноземельные металлы. Реакция йода с щелочноземельными металлами является экзотермической, то есть сопровождается выделением тепла.
Уравнение реакции йода с щелочноземельными металлами можно записать следующим образом:
- Медленная реакция: I2 + 2M → 2MI, где M – щелочноземельный металл (кальций, магний, бериллий, стронций, барий или радий).
- Быстрая реакция: I2 + 2M → 2MI2, где M – щелочноземельный металл (кальций, магний, бериллий, стронций, барий или радий).
Стоит отметить, что реакция йода с щелочноземельными металлами происходит при обычных условиях, но может быть активизирована при нагревании или использовании катализаторов.
Примером реакции йода с щелочноземельным металлом может служить реакция магния (Mg) с йодом (I2):
- I2 + 2Mg → 2MgI2
В результате этой реакции образуется йодид магния (MgI2) – белый кристаллический порошок, который хорошо растворим в воде.
На практике реакцию между йодом и щелочноземельными металлами можно использовать для получения йодидов металлов, которые имеют различные применения в химической промышленности и лабораторных исследованиях.
Уравнение реакции йода с переходными металлами

Переходные металлы являются важными компонентами в химических реакциях благодаря своей уникальной реакционной активности. Реакция йода с переходными металлами также имеет свои особенности и может протекать при определенных условиях.
Одним из примеров такой реакции является реакция йода с железом. Уравнение данной реакции выглядит следующим образом:
2 Fe + 3 I2 → 2 FeI3
В ходе этой реакции атомы железа обмениваются электронами с молекулами йода, что приводит к образованию йодида железа. Это важное соединение, которое может применяться в различных областях, таких как медицина и химическая промышленность.
Кроме того, реакция йода с другими переходными металлами также может протекать, но требует определенных условий, таких как наличие катализатора или особой температуры. Например, реакция йода с медью может протекать при высоких температурах и с образованием йодида меди.
Таким образом, уравнение реакции йода с переходными металлами позволяет понять механизмы взаимодействия этих важных химических элементов. Эти реакции имеют практическое применение и являются объектом изучения в области химии.
Примеры реакций йода с различными металлами
Йод - это химический элемент с атомным номером 53. Он относится к галогенам и обладает высокой реакционной способностью. Йод может образовывать сложные соединения с различными металлами, образуя йодиды металлов.
Например, реакция йода с алюминием приводит к образованию йодида алюминия (AlI3). Эта реакция происходит при нагревании алюминия с йодом в отсутствии воздуха. Йодид алюминия обладает высокой стабильностью и используется в качестве катализатора при некоторых органических реакциях.
Другой пример реакции йода с металлом - реакция йода с цинком. При взаимодействии этих веществ образуется йодид цинка (ZnI2). Йодид цинка обладает белым цветом и может использоваться в медицине для лечения заболеваний щитовидной железы.
Еще одним примером реакции йода с металлом является реакция йода с железом. При нагревании йода с железом образуется йодид железа (FeI2) или йодид железа (FeI3), в зависимости от соотношения компонентов реакции. Эти соединения имеют различные свойства и могут использоваться в различных областях промышленности.
Также можно упомянуть реакцию йода с медью. При взаимодействии этих веществ образуется йодид меди (CuI), который имеет желтый цвет. Йодид меди также может использоваться в медицинских препаратах и в качестве пигмента в некоторых промышленных процессах.
Это лишь некоторые примеры реакций йода с различными металлами. Реакции между йодом и металлами могут иметь различные условия протекания и приводить к образованию различных соединений. Изучение таких реакций является важной задачей современной химии.
Вопрос-ответ

Что такое уравнение реакции йода с металлами?
Уравнение реакции йода с металлами - это химическое уравнение, описывающее процесс взаимодействия йода с металлом. В результате этой реакции образуется йодид металла.
Какие особенности уравнения реакции йода с металлами?
Уравнение реакции йода с металлами обычно содержит сложные формулы и требует балансировки, так как металл может иметь различные степени окисления. Кроме того, реакция йода с металлами может протекать только в присутствии воды или другого растворителя.
