Уравнение реакций с щелочными металлами – это процесс записи и описания химических реакций, включающих в себя щелочные металлы, такие как литий, натрий, калий и др. Важно понимать, что щелочные металлы относятся к элементам первой группы периодической системы и обладают уникальными свойствами, которые определяют их химическое поведение.
Основные принципы уравнения реакций с щелочными металлами заключаются в учете баланса массы и заряда при взаимодействии щелочного металла с другим веществом или соединением. Каждый щелочный металл обладает способностью образовывать ион положительного заряда при потере одного электрона, что является основой для реакций с другими веществами.
Примером реакции с щелочными металлами может служить реакция натрия с водой. В данном случае, натрий активно взаимодействует с молекулами воды и образует гидроксид натрия и выходит водородный газ:
2Na + 2H₂O → 2NaOH + H₂↑
В данном примере видно, что происходит гидролиз щелочного металла натрия, при условии, что реакция происходит в водной среде. Такие реакции с щелочными металлами являются характерными для всех элементов этой группы и проявляются во многих химических процессах.
Основные принципы уравнения реакций

Уравнение реакций – это способ записи химической реакции с определением реагентов и продуктов. Оно позволяет понять, какие вещества участвуют в реакции и как они связаны друг с другом.
Основные принципы уравнения реакций с щелочными металлами включают соблюдение закона сохранения массы и заряда. Закон сохранения массы утверждает, что сумма масс реагентов должна быть равна сумме масс продуктов. Закон сохранения заряда указывает на то, что сумма зарядов реагентов должна быть равна сумме зарядов продуктов.
При уравнении реакций с щелочными металлами важно учитывать их химические свойства. Щелочные металлы, такие как натрий, калий и литий, имеют один валентный электрон, который легко отдается при взаимодействии с другими веществами. В результате реакций с щелочными металлами образуются ионы щелочных металлов и соответствующие продукты.
Для правильного уравнения реакций с щелочными металлами необходимо знать их степень окисления. Степень окисления щелочных металлов в ионах равна +1, так как они легко отдают свой электрон. При уравнении реакций необходимо учесть количество ионов щелочных металлов и соответствующих ионов в реагентах и продуктах.
В химических уравнениях с щелочными металлами также можно использовать индексы для обозначения количества веществ. Например, Na2O обозначает наличие двух ионов натрия и одного иона кислорода в соединении. Использование индексов позволяет точнее указать состав и количество веществ в уравнении.
Примеры уравнений с щелочными металлами

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются очень активными химическими элементами. Они имеют свойство образовывать ионы металла с однозарядным положительным зарядом, что делает их сильными основаниями.
Такое свойство щелочных металлов может быть продемонстрировано через реакцию с водой. Например, литий реагирует с водой, образуя гидроксид лития и выделение водорода по следующему уравнению:
2Li + 2H2O → 2LiOH + H2
Образовавшийся гидроксид лития является сильным основанием и образует щелочную среду в растворе.
Еще одним примером реакции с щелочными металлами может быть реакция натрия с кислородом, образующая оксид натрия:
4Na + O2 → 2Na2O
Оксид натрия также является щелочным и образует щелочную среду в растворе.
Кроме того, щелочные металлы могут реагировать с кислотами. Например, реакция калия с соляной кислотой приводит к образованию хлорида калия и выделению водорода:
2K + 2HCl → 2KCl + H2
Получившийся хлорид калия также является солью щелочного металла и образует щелочную среду в растворе.
Уравнение реакций с литием: основные принципы и примеры
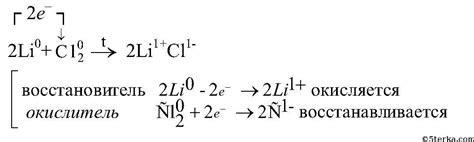
Литий является одним из щелочных металлов, химический символ которого - Li. Этот металл является очень реактивным и может вступать в реакции с различными соединениями.
Основной принцип уравнения реакций с литием заключается в балансировке реагентов и продуктов. Реагенты должны правильно соотноситься с продуктами в соответствии с принципами сбалансированных уравнений реакций.
Примером реакции с литием является его реакция с водой. В результате этой реакции образуются гидроксид лития и молекулярный водород. Уравнение данной реакции можно записать следующим образом:
2Li + 2H2O → 2LiOH + H2
Также литий может реагировать с кислородом воздуха, образуя оксид лития. Уравнение этой реакции:
4Li + O2 → 2Li2O
Таким образом, уравнение реакций с литием позволяет предсказать продукты данных реакций и сбалансировать их в соответствии с химическими принципами.
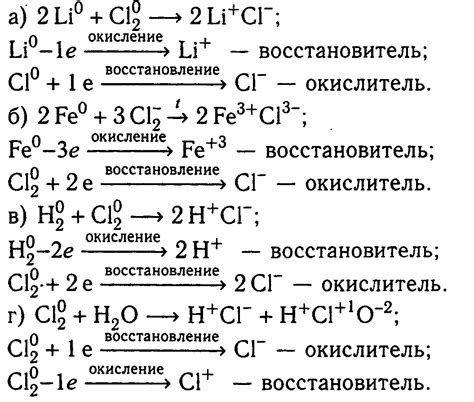
Уравнение реакций с натрием: основные принципы и примеры
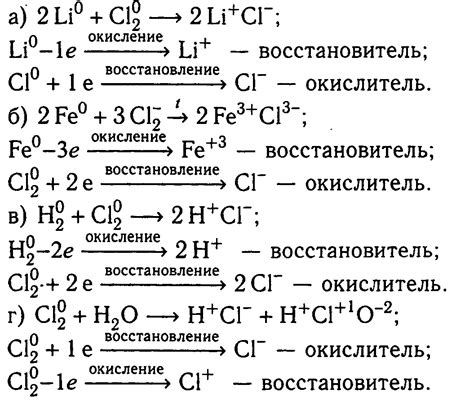
Натрий (Na) является одним из наиболее распространенных щелочных металлов. Уравнение реакции с натрием может быть записано в соответствии с общими принципами химических реакций.
Натрий обладает положительным зарядом и легко отдает одну электронную пару при взаимодействии с другими элементами. Уравнение реакции с натрием может быть записано в форме:
Na + X → NaX
где X представляет собой любой другой элемент или группу элементов. Натрий часто реагирует с кислородом, образуя оксид натрия:
Na + 1/2O2 → Na2O
Кроме того, натрий может реагировать с водой, образуя гидроксид натрия и высвобождая водород:
2Na + 2H2O → 2NaOH + H2
Уравнение реакции с натрием может также включать реакцию с кислотой, образуя соль и высвобождая водород:
2Na + 2HCl → 2NaCl + H2
Таким образом, уравнения реакций с натрием могут быть использованы для объяснения различных физико-химических процессов, включая окисление, гидролиз и нейтрализацию.
Уравнение реакций с калием: основные принципы и примеры
Калий – щелочной металл, взаимодействие с которым может привести к различным реакциям. Основные принципы уравнения реакций с калием заключаются в определении соответствующих реагентов и продуктов. Калий может взаимодействовать с кислородом, водой, кислотами, а также другими веществами, образуя разнообразные соединения.
Один из наиболее характерных примеров реакции с калием – его реакция с водой. При этом образуется щелочной гидроксид и выделяется водородный газ. Уравнение такой реакции может быть представлено следующим образом:
- 2K + 2H2O → 2KOH + H2
Если к калию добавить кислород, произойдет его окисление, формируя оксид калия. Уравнение данной реакции выглядит следующим образом:
- 4K + O2 → 2K2O
Кроме того, калий может реагировать с различными кислотами. Например, при взаимодействии с серной кислотой образуется калийная соль и выделяется сернистый газ. Уравнение такой реакции можно записать следующим образом:
- K + H2SO4 → K2SO4 + SO2 + H2O
В результате данных примеров можно сделать вывод о том, что реакции с калием являются типичными для щелочных металлов и имеют свои характерные особенности. Умение уравновешивать реакции с калием позволяет лучше понять процессы, происходящие между веществами и предсказывать их результаты.
Вопрос-ответ

Какие принципы лежат в основе уравнения реакций с щелочными металлами?
Основные принципы уравнения реакций с щелочными металлами включают балансировку химических уравнений, определение степени окисления и ионного состава реагентов и продуктов, а также осуществление перевода уравнений в ионную форму.
Какие реакции можно рассмотреть как примеры уравнений с щелочными металлами?
Примерами реакций, которые можно рассмотреть в качестве примеров уравнений с щелочными металлами, являются реакции лития с кислородом, натрия с водой и калия с хлором.
Каким образом балансируются уравнения реакций с щелочными металлами?
Уравнения реакций с щелочными металлами балансируются путем изменения коэффициентов перед реагентами и продуктами таким образом, чтобы число атомов каждого элемента на левой и правой сторонах уравнения было одинаковым.
Каким образом определяется степень окисления в реакциях с щелочными металлами?
Степень окисления в реакциях с щелочными металлами определяется путем анализа электронного строения атомов веществ, участвующих в реакции и выявления изменения заряда на атоме при образовании ионов.
