Оксиды металлов являются одним из основных классов неорганических соединений, образуемых при взаимодействии металлов с кислородом. Процесс образования оксида металла называется окислением. Он имеет большое значение как в химической промышленности, так и в природе.
Оксиды металлов обладают различными физическими и химическими свойствами, и их образование осуществляется путем реакции между металлом и кислородом. Уравнение реакции образования оксида металла показывает, как молекулы металла и кислорода соединяются, чтобы образовать соединение с определенным соотношением компонентов.
Общий вид уравнения реакции формирования оксида металла выглядит следующим образом: металл + кислород → оксид металла. Например, формула уравнения реакции образования оксида металла известного соединения оксида железа будет следующей: железо + кислород → оксид железа.
Уравнение реакции образования оксида металла позволяет увидеть, какие именно атомы и ионы участвуют в процессе окисления металла. Оно также позволяет определить соотношение между металлом и кислородом в образующемся соединении. Знание уравнения реакции формирования оксида металла важно для понимания энергетических и химических свойств оксидов и их применения в различных областях науки и техники.
Стадия взаимодействия металла с кислородом
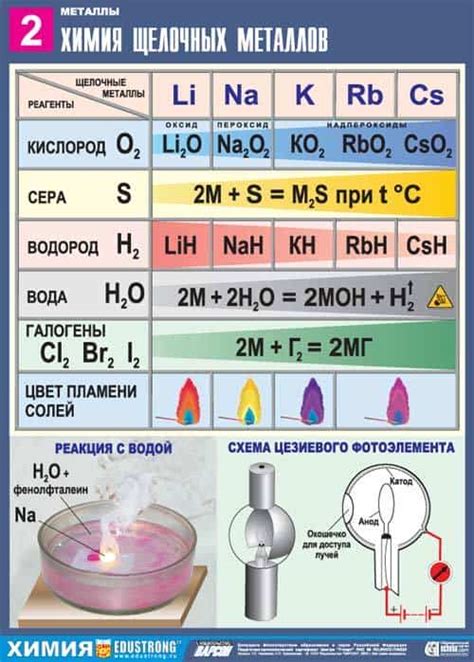
Стадия взаимодействия металла с кислородом является критической для образования оксида металла. При этом происходит окисление металла, то есть передача электронов между металлом и кислородом. Этот процесс может происходить при нагревании металла в присутствии кислорода или при растворении металла в кислородсодержащем растворе.
Процесс взаимодействия металла с кислородом зависит от различных факторов, включая валентность металла, температуру окружающей среды и концентрацию кислорода. В зависимости от условий, металл может образовывать различные оксиды, такие как оксиды с переменным содержанием кислорода или оксиды с определенной валентностью.
В процессе взаимодействия металла с кислородом происходит передача электронов от металла к кислороду. Металл окисляется, а кислород восстанавливается. Окисленный металл образует оксид, который может иметь различные физические и химические свойства. При этом порядок реакции и скорость образования оксида зависят от ряда факторов, включая поверхность металла, его активность и концентрацию кислорода.
Выводя общую схему реакции взаимодействия металла с кислородом, можно выделить основные стадии: ионизация металла, образование оксида, растекание оксида по поверхности металла и диффузия кислорода через оксидную пленку. Все эти процессы происходят параллельно и взаимосвязаны. Исследование этих стадий важно для понимания и контроля окисления металлов и разработки новых материалов с улучшенными свойствами.
Химическая формула образовавшегося оксида металла

Процесс формирования оксида металла происходит при взаимодействии металла с кислородом, что приводит к образованию соединения, называемого оксидом металла. Химическая формула оксида металла состоит из символов металла и кислорода, которые указывают на количество атомов каждого элемента.
Например, для образования оксида железа химическая формула будет Fe₂O₃. Здесь символ Fe обозначает железо, а индекс ₂ указывает на количество атомов железа в молекуле оксида. Символ O обозначает кислород, а индекс ₃ указывает на количество атомов кислорода в молекуле оксида.
Химическая формула оксида металла позволяет определить соотношение атомов между металлом и кислородом в соединении. Например, в оксиде железа Fe₂O₃ на каждых два атома железа приходится три атома кислорода.
Зная химическую формулу оксида металла, можно провести расчеты с учетом стехиометрии реакции, определить массу и объем образовавшегося соединения, а также прогнозировать его свойства и применение в различных областях науки и промышленности.
Важность уравнения реакции образования оксида металла

Уравнение реакции образования оксида металла является важным инструментом для изучения и понимания процесса образования оксидов. Оно позволяет нам представить химическую реакцию в виде символов и формул, что делает ее более наглядной и удобной для анализа.
Важно отметить, что уравнение реакции образования оксида металла представляет собой балансировку числа атомов каждого элемента в реакции. Это позволяет нам определить точки старта и конца реакции, учитывая все входящие и выходящие вещества.
Знание уравнения реакции образования оксида металла позволяет ученым и химикам прогнозировать и предсказывать результаты реакции, а также оптимизировать процессы синтеза оксидов. Это особенно важно при разработке новых материалов и технологий, где оксиды металлов могут играть важную роль.
Уравнение реакции образования оксида металла также помогает в понимании свойств оксидов и их взаимодействия с другими веществами. Например, зная уравнение реакции образования оксида металла, можно предсказать его растворимость, кислотные или щелочные свойства, а также его влияние на окружающую среду.
В заключение, уравнение реакции образования оксида металла играет важную роль в изучении химических реакций и свойств оксидов металлов. Оно позволяет ученым анализировать, прогнозировать и оптимизировать процессы образования оксидов, а также понимать их влияние и взаимодействие в различных ситуациях.
Роль оксидов металла в промышленных процессах
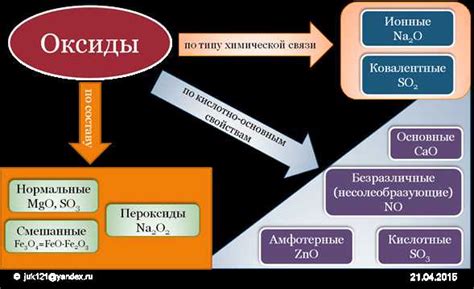
Оксиды металла играют важную роль в промышленных процессах, поскольку они обладают рядом полезных свойств и широко используются в различных отраслях промышленности.
Во-первых, оксиды металла являются важными катализаторами в химической промышленности. Они способны ускорять химические реакции и повышать их эффективность. Например, оксиды металла часто используются в производстве катализаторов для процессов газообразования и окисления.
Во-вторых, оксиды металла широко применяются в процессе получения металлов из руд. Они служат важными промежуточными продуктами в химических реакциях, которые позволяют извлекать ценные металлы из их природных источников. Например, оксид железа (Fe2O3) используется в процессе производства чугуна и стали.
Кроме того, оксиды металла играют роль в процессе окрашивания материалов. Благодаря своим определенным свойствам оксиды металла могут придавать материалам различные оттенки и цвета. Например, оксиды железа используются в производстве красителей для красок, косметики и керамической промышленности.
Более того, оксиды металла применяются в процессе производства электроники. Некоторые оксиды металла обладают полупроводниковыми свойствами, что позволяет использовать их в изготовлении полупроводниковых элементов, таких как диоды и транзисторы. Например, оксид кремния (SiO2) широко используется в производстве микрочипов и солнечных батарей.
Вопрос-ответ

Какой химический процесс происходит при формировании оксида металла?
При формировании оксида металла происходит химическая реакция, в результате которой металл соединяется с кислородом из воздуха, образуя оксид металла.
Какие вещества участвуют в процессе формирования оксида металла?
В процессе формирования оксида металла участвуют металл и кислород из воздуха. Металл соединяется с кислородом, образуя оксид металла.
Как можно описать уравнение реакции формирования оксида металла?
Уравнение реакции формирования оксида металла имеет вид: металл + кислород -> оксид металла. Здесь металл соединяется с кислородом, образуя оксид металла. Например, уравнение реакции для формирования оксида железа будет выглядеть так: 4Fe + 3O2 -> 2Fe2O3.
