Уравнение реакции между оксидом металла и углем является основой для понимания процессов, происходящих при получении металлов из их руд. Эта реакция является одной из важнейших реакций в химии и имеет широкое практическое применение.
Уравнение такой реакции обычно выглядит следующим образом: оксид металла + уголь → металл + углекислый газ. Здесь оксид металла и уголь являются исходными веществами, а металл и углекислый газ — продуктами реакции.
Процесс происходит при нагревании и включает в себя обмен кислорода между оксидом металла и углем. Уголь при этом служит восстановителем оксида металла, а металл образуется в результате реакции.
Уравнения таких реакций могут быть сложными и требуют математического решения для определения пропорций веществ и условий проведения реакции. Это позволяет ученым и инженерам эффективно контролировать процесс получения металлов с помощью этой реакции.
Оксиды металлов
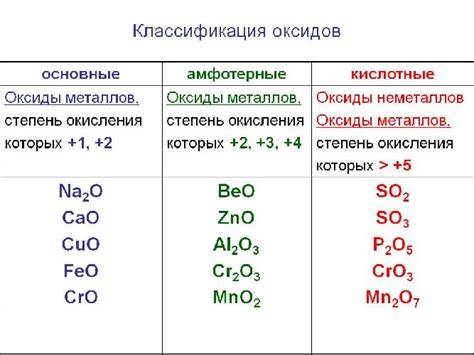
Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода. Они широко распространены в природе и являются основными компонентами многих минералов, руд и почв. Оксиды металлов имеют различные физические и химические свойства, которые зависят от характеристик самого металла.
Одним из наиболее известных оксидов металлов является оксид железа, или ржавчина. Оксид железа имеет красно-коричневый цвет и применяется в качестве пигмента в красках и косметике. Его также можно встретить в природных искусственных красках, таких как триоксид железа, известный как красный оксид железа.
Другим примером оксида металла является оксид алюминия. Он обладает белым цветом и используется в производстве керамики, стекла и алюминиевого металла. Оксид алюминия имеет высокую теплоотдачу и сопротивление к химическим реакциям, что делает его полезным в различных промышленных процессах.
Другие примеры оксидов металлов включают оксиды меди, цинка, свинца и многих других металлов. Они имеют различные цвета, свойства и применения. Оксиды металлов играют важную роль в современной науке и технологии, находя применение в производстве электроники, катализаторах, пищевых добавках и многих других областях.
Уголь

Уголь - это органическое твёрдое топливо, которое образуется в результате процесса углеобразования. Уголь является одним из основных видов полезных ископаемых, которое широко используется в сфере энергетики и промышленности.
Уголь обладает высоким содержанием углерода и может содержать различные примеси, включая серу, азот, водород и кислород. В зависимости от содержания этих примесей, уголь может быть различных типов: каменный, коксующийся, бурый и битуминозный. Каждый из этих типов обладает своими характеристиками и применяется в различных отраслях промышленности.
Уголь широко используется как источник энергии. Он сжигается в электростанциях и тепловых центрах для получения электроэнергии и теплоты. Помимо этого, уголь применяется в металлургической промышленности для получения чугуна и стали. В процессе прокаливания угля получают кокс, который используется в производстве чугуна и алюминия.
Однако уголь также имеет негативный экологический эффект. Он является источником выбросов парниковых газов, включая углекислый газ и оксиды азота. Поэтому современные технологии энергетики стремятся к уменьшению использования угля в пользу более экологически чистых источников энергии, таких как ветроэнергия и солнечная энергия.
В целом, уголь играет важную роль в мировой промышленности и энергетике. У него есть много преимуществ, включая широкое обеспечение и низкую цену. Однако, необходимо учитывать его негативное воздействие на окружающую среду и активно развивать устойчивые и экологически чистые технологии производства энергии.
Реакция образования карбида металла
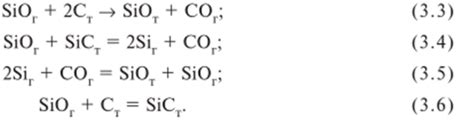
Реакция образования карбида металла происходит при взаимодействии оксида металла и угля. В результате этой реакции образуется карбид металла, который является соединением между металлом и углеродом.
Карбид металла имеет важное применение в различных отраслях промышленности. Например, карбид кальция используется в производстве карбида кальция, который широко применяется в процессе десульфурации стали, а также в производстве кетена и ацетилена.
Процесс образования карбида металла обычно происходит при высоких температурах и в условиях отсутствия кислорода. В результате взаимодействия оксида металла с углем образуется карбид металла и выделяется углекислый газ.
Реакция образования карбида металла является экзотермической, то есть сопровождается выделением тепла. При этом происходит соединение металла с углеродом, образуя кристаллическую структуру карбида.
Образование карбида металла может быть представлено следующим уравнением реакции: Оксид металла + уголь → Карбид металла + Углекислый газ.
Реакция образования карбида металла является важным процессом в химической промышленности, так как карбид металла применяется в производстве различных материалов и соединений, а также в качестве катализатора в химических реакциях.
Восстановление оксида металла

Восстановление оксида металла - это химическая реакция, при которой оксид металла превращается в металл или соединение металла. Этот процесс часто происходит при взаимодействии оксида металла с углем.
Уголь является хорошим восстановителем, так как он содержит большое количество углерода. При нагревании оксида металла с углем происходит реакция, в результате которой уголь отдаёт свой углерод оксиду металла, снижая его окислительные свойства.
Восстановление оксида металла с помощью угля широко применяется в промышленности. Эта реакция используется, например, при получении металлов из их руд. Одна из таких реакций - восстановление железной руды. При этом происходит восстановление оксида железа (III) углём, что приводит к получению чистого железа и выделению углекислого газа.
Реакция восстановления оксида металла может быть представлена следующим уравнением:
- Металл оксид + уголь → металл + углекислый газ
Процесс восстановления оксида металла является важным химическим процессом, который может быть использован для получения металлов или их соединений, а также для очистки различных материалов от окислов и примесей.
Примеры реакций

Реакция между оксидом железа(II) и углем: Эта реакция представляет собой пример редукции. Когда оксид железа(II) взаимодействует с углем, происходит передача электронов от углерода к железу, что приводит к образованию железа и оксида углерода.
Реакция между оксидом меди(II) и углем: В процессе реакции оксид меди(II) взаимодействует с углем, при этом происходит редукция оксида меди(II) и образование меди и оксида углерода.
Реакция между оксидом свинца(II) и углем: При взаимодействии оксида свинца(II) с углем происходит редукция оксида свинца(II), в результате чего образуются свинец и оксид углерода.
Реакция между оксидом никеля(II) и углем: Эта реакция является примером редукции. Когда оксид никеля(II) вступает в реакцию с углем, происходит передача электронов от углерода к никелю, что приводит к образованию никеля и оксида углерода.
Реакция между оксидом цинка и углем: При взаимодействии оксида цинка с углем происходит редукция оксида цинка, в результате чего образуются цинк и оксид углерода.
Практическое применение

Уравнение реакции между оксидом металла и углем имеет множество практических применений в различных отраслях промышленности и научной деятельности.
Одно из основных применений данного типа реакции - получение металлов. Реакция оксида металла с углем позволяет производить выделение и очистку многих металлов, таких как железо, алюминий, медь и др. Такой процесс активно используется в металлургической промышленности для получения чистых металлических материалов.
Кроме того, реакция оксида металла с углем применяется в пиротехнической промышленности. Для создания различных эффектов, таких как искры и пламя, используются смеси оксидов металлов и угля, которые при воспламенении образуют специфический светящийся эффект.
Уравнение реакции между оксидом металла и углем также находит применение в химическом анализе. С помощью данной реакции можно определить содержание металла в пробе, а также выполнить качественный химический анализ различных соединений.
Кроме того, данная реакция широко используется в катализе. Катализ является важным процессом в химии и промышленности, он позволяет ускорить химическую реакцию и снизить энергозатраты на процесс. Реакция между оксидом металла и углем может быть использована в качестве катализатора при производстве различных продуктов, таких как пластик, бензин, аммиак и др.
Таким образом, уравнение реакции между оксидом металла и углем имеет широкое практическое применение в различных отраслях промышленности и научной деятельности, играя важную роль в получении металлов, в пиротехнике, в химическом анализе и в катализе.
Вопрос-ответ

