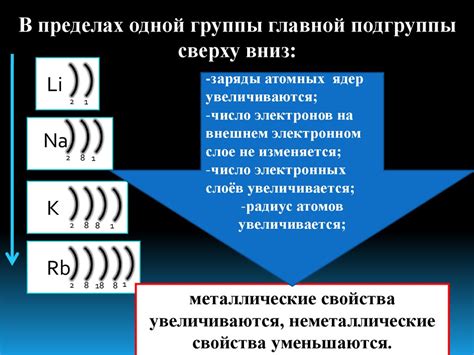
Щелочные металлы - это элементы, которые находятся в первой группе периодической системы и включают литий, натрий, калий, рубидий, цезий и франций. Они известны своей высокой реактивностью и способностью легко отдавать свои валентные электроны.
Одной из характеристик щелочных металлов является то, что они имеют только один электрон на своем внешнем энергетическом уровне. Такой конфигурации придает этим элементам высокую химическую активность и способность образовывать сильно щелочные растворы.
Однако, в некоторых случаях, число электронов на внешнем энергетическом уровне в щелочных металлах может быть уменьшено. Это может произойти при образовании ионов или соединений с другими элементами. В таких случаях, щелочный металл отдает свой валентный электрон или электроны, чтобы образовать стабильный химический связи с другими атомами.
Например, натрий может образовать ион Na+ путем отдачи своего валентного электрона. Это происходит при реакции с водородом, формируя натриевую соль NaH.
Уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах может привести к изменению их химических свойств и реактивности. Это имеет важное значение в различных химических процессах и применениях, включая использование щелочных металлов в батареях, солнечных элементах и других электронных устройствах.
Уменьшение числа электронов: внешний энергетический уровень щелочных металлов

Щелочные металлы являются группой элементов, которые находятся в первой группе периодической таблицы. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Все они обладают преимущественно одной электронной оболочкой с одним электроном на внешнем энергетическом уровне.
Однако, при некоторых условиях, щелочные металлы могут потерять свой внешний электрон и стать катионами с положительным зарядом. Этот процесс называется ионизацией.
Уменьшение числа электронов на внешнем энергетическом уровне щелочных металлов может происходить в различных ситуациях. Одним из примеров является реакция щелочных металлов с халкогенами (группа 17 периодической таблицы), такими как хлор (Cl) или бром (Br), при образовании ионов металлических катионов и анионов хлорида или бромида. Это происходит за счет передачи электрона от металла к халкогену.
Уменьшение числа электронов на внешнем энергетическом уровне щелочных металлов также может происходить в процессе реакции с кислородом (O) или другими неметаллами, образуя оксиды или соединения с неметаллическими катионами. Например, щелочные металлы могут образовывать оксиды, такие как оксид натрия (Na2O), путем передачи электрона от металла к кислороду.
Основные принципы
Щелочные металлы являются элементами первой группы периодической системы и включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют один валентный электрон на внешнем энергетическом уровне и отличаются от других элементов по своим свойствам.
Уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах происходит путем образования ионов положительного заряда. Это происходит при потере одного или нескольких электронов. В результате щелочные металлы образуют ионы, которые имеют положительный заряд и электронную конфигурацию заполненной внутренней оболочки.
Уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах является энергетически выгодным процессом, так как в результате образуется ион с более стабильной электронной конфигурацией. Это связано с тем, что положительные ионы имеют меньшую электронную оболочку и меньшую электронную отталкивающую энергию.
Уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах происходит при взаимодействии с другими элементами или соединениями. Например, реакция металла с хлором приводит к образованию иона металла с положительным зарядом и иона хлора с отрицательным зарядом.
Таким образом, уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах является фундаментальным принципом, определяющим их реактивность и свойства.
Структура атома щелочных металлов

Атомы щелочных металлов, таких как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), имеют простую структуру и состоят из трех основных частей: ядра, электронных оболочек и внешнего энергетического уровня.
Ядро атома щелочных металлов содержит протоны (частицы с положительным зарядом) и нейтроны (частицы без заряда), которые образуют основную массу атома. Протоны определяют химические свойства атома, а нейтроны участвуют в формировании стабильности ядра.
Вокруг ядра атома расположены электронные оболочки, которые содержат электроны - частицы с отрицательным зарядом. Количество электронов в каждой оболочке определяется с использованием числа, соответствующего её номеру (оболочка 1 содержит 2 электрона, оболочка 2 - 8 электронов, оболочка 3 - 8 электронов и так далее).
Все щелочные металлы имеют один внешний энергетический уровень с одним электроном на этом уровне. Этот электрон называется валентным электроном и определяет химические свойства металла. Уменьшение числа электронов на внешнем энергетическом уровне может произойти при взаимодействии с другими веществами, что влияет на химическую реактивность и реакционную способность щелочных металлов.
Электронная конфигурация
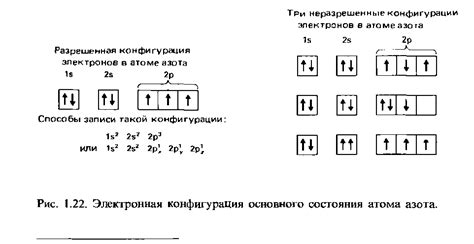
Электронная конфигурация – это распределение электронов в атоме, которое определяет его химические свойства. В щелочных металлах, таких как литий, натрий и калий, электронная конфигурация имеет особенности, связанные с наличием одного электрона на внешнем энергетическом уровне.
Один электрон на внешнем энергетическом уровне делает эти металлы очень реакционноспособными. На практике это означает, что они легко отдают этот электрон, чтобы стать положительно заряженными ионами. Этот процесс связан с образованием ионной связи и позволяет щелочным металлам образовывать соединения с другими элементами.
Например, литий (Li) имеет электронную конфигурацию 1s2 2s1. «1s2» означает, что на первом энергетическом уровне находятся два электрона, а «2s1» означает, что на втором энергетическом уровне находится один электрон. Этот один электрон на внешнем энергетическом уровне делает литий очень реакционноспособным, и он легко отдает его, чтобы стать положительно заряженным ионом Li+.
В целом, электронная конфигурация в щелочных металлах определяет их активность и химические свойства. Эти металлы обладают способностью легко отдавать свой внешний электрон, что делает их полезными в реакциях и образовании соединений с другими элементами.
Потеря электронов
В щелочных металлах, таких как литий, натрий, калий и др., электроны находятся на внешнем энергетическом уровне. Потеря электронов является одним из основных свойств этих металлов.
Потеря электронов происходит при взаимодействии металлов с другими веществами или при высоких температурах. В результате потери электрона, металл превращается в положительно заряженный ион.
Для щелочных металлов потеря электрона является выгодным процессом, так как это позволяет достичь более стабильной конфигурации электронной оболочки. При этом металлы становятся более реакционноспособными и могут легко образовывать соединения с другими элементами.
Потеря электронов в щелочных металлах имеет много практических применений. Например, натрий используется в процессе образования жидкого стекла, а калий - для производства удобрений. Кроме того, потерю электронов можно использовать в различных химических реакциях и технологических процессах.
В заключение, потеря электронов в щелочных металлах является важным свойством, которое позволяет им проявлять характерные химические и физические свойства. Это свойство находит применение в различных областях науки и промышленности.
Химические свойства щелочных металлов

1. Активность щелочных металлов. Щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) относятся к самым активным элементам периодической системы. Они легко вступают в реакцию с водой, кислородом и галогенами, проявляя высокую реактивность. Эта активность объясняется малой энергией ионизации внешнего энергетического уровня, что способствует легкому отдаче электронов.
2. Способность щелочных металлов образовывать ионы. Щелочные металлы имеют один электрон на внешнем энергетическом уровне, что делает их склонными отдавать этот электрон и образовывать положительные ионы. Благодаря этому, щелочные металлы образуют соли с отрицательно заряженными ионами, такими как галогени или анионы кислот.
3. Реакция щелочных металлов с водой. Щелочные металлы реагируют с водой, выделяя водород и образуя щелочные гидроксиды. Так, например, литий реагирует с водой, образуя гидроксид лития и выделяя водород. Эта реакция является экзотермической и сопровождается выделением тепла.
4. Способность щелочных металлов присоединяться к кислороду. Щелочные металлы реагируют с кислородом, образуя оксиды щелочных металлов. Например, калий реагирует с кислородом, образуя оксид калия. Эти оксиды располагаются в периодической системе между группами щелочных металлов и благодаря своей реактивности находят применение в различных индустриальных процессах.
5. Образование амальгам. Щелочные металлы легко образуют амальгамы с ртутью, что делает их особенно полезными в аналитической химии и электротехнике. Амальгамы щелочных металлов обладают высокой электропроводностью и используются в производстве электролизеров и электронных устройств.
Влияние уменьшения числа электронов на внешнем энергетическом уровне в щелочных металлах
Уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах имеет существенное влияние на их свойства и химическую реактивность. Щелочные металлы, такие как литий, натрий, калий и прочие, обладают одним электроном на своем внешнем энергетическом уровне.
Уменьшение числа электронов на внешнем энергетическом уровне приводит к увеличению тяжелости и размеров ионов щелочных металлов. Это связано с тем, что меньшее количество электронов слабее притягивается ядром, что приводит к расширению электронной оболочки и, следовательно, увеличению размеров ионов.
Уменьшение числа электронов также влияет на ионный радиус и степень поляризации атомов. Благодаря малому размеру щелочных металлов и большому радиусу своих положительно заряженных ионов, они проявляют сильное влияние на окружающие их атомы и молекулы. Уменьшение числа электронов на внешнем энергетическом уровне делает щелочные металлы очень реакционноспособными и химически активными.
Электроотрицательность щелочных металлов также увеличивается при уменьшении числа электронов на внешнем энергетическом уровне. Это означает, что они становятся более способными принимать электроны от других атомов или молекул, что, в свою очередь, способствует более активным химическим реакциям.
Применения в технологиях

Уменьшение числа электронов на внешнем энергетическом уровне в щелочных металлах имеет широкий спектр применений в различных технологиях.
В первую очередь, щелочные металлы, такие как литий, натрий, калий и др., используются в производстве аккумуляторов, благодаря своей способности передавать электроны. Такие аккумуляторы широко применяются в электронике, медицинском оборудовании, электромобилях и других сферах, где требуется надежный и эффективный источник энергии.
Второе применение уменьшения числа электронов на внешнем энергетическом уровне щелочных металлов связано с их использованием в качестве катализаторов. Щелочные металлы могут обладать высокой активностью в различных химических реакциях, таких как гидрирование и дефторирование, благодаря частичной потере электронов на внешнем энергетическом уровне. Это позволяет ускорять и эффективно контролировать химические процессы в промышленности и лабораториях.
Третье применение уменьшения числа электронов на внешнем энергетическом уровне щелочных металлов связано с применением их в производстве стекла и керамики. Щелочные металлы являются важными компонентами этих материалов и влияют на их свойства, такие как прозрачность, прочность и электропроводность. Уменьшение числа электронов на внешнем энергетическом уровне позволяет достичь определенной структуры и химического соединения, что обеспечивает нужные свойства конечного продукта.
Также, щелочные металлы находят применение в производстве солнечных батарей и плазменных дисплеев, где их свойства уменьшения числа электронов играют важную роль в работе этих устройств. Они также используются в электротехнике и электропроводимых покрытиях, снижая уровень электрического сопротивления и улучшая электрическую проводимость материалов.
Вопрос-ответ

Какую роль играют электроны на внешнем энергетическом уровне в щелочных металлах?
Электроны на внешнем энергетическом уровне в щелочных металлах играют ключевую роль в химических реакциях и связываются с другими атомами, образуя соединения.
Почему количество электронов на внешнем энергетическом уровне в щелочных металлах может быть уменьшено?
Количество электронов на внешнем энергетическом уровне в щелочных металлах может быть уменьшено из-за взаимодействия с другими атомами или молекулами, которые могут принять один или несколько электронов от щелочного металла.
