Щелочные металлы - это группа элементов периодической таблицы, которые включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получили свое название из-за того, что они реагируют с водой, образуя щелочные растворы.
Число валентных электронов щелочных металлов - это число электронов во внешней оболочке атома. Все щелочные металлы имеют одну валентную электронную оболочку, обозначаемую как s-орбиталь, которая содержит одну или две электронные пары. Это делает щелочные металлы очень реактивными и склонными к образованию ионов положительного заряда.
Из-за наличия только одной валентной электронной оболочки, щелочные металлы легко теряют свою внешнюю электронную оболочку, образуя катионы. Это связано с тем, что для достижения стабильной конфигурации электронов, им необходимо потерять один электрон. Полученные катионы имеют положительный заряд, который компенсируется отрицательными зарядами электронов в более низких энергетических уровнях.
Важно отметить, что щелочные металлы имеют наименьшую энергию ионизации среди всех элементов в периодической таблице. Это означает, что потеря их валентного электрона требует меньшего количества энергии, чем для других элементов. Это делает щелочные металлы очень реактивными и способными образовывать стабильные ионы.
Число валентных электронов щелочных металлов также определяет их химические свойства и способность образовывать соединения с другими элементами. Благодаря своей высокой реактивности, щелочные металлы широко используются в различных областях, включая производство батарей, легирование металлов, производство лекарственных препаратов и даже в космической индустрии.
Химические характеристики щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают определенными химическими характеристиками, связанными с их электронной структурой. В частности, щелочные металлы имеют всего один валентный электрон в своей внешней оболочке. Это делает их очень реактивными и склонными к образованию ионов положительной заряды.
Взаимодействие щелочных металлов с другими элементами находит свое проявление в различных химических реакциях. Например, с водой они образуют щелочные гидроксиды, такие как гидроксид лития (LiOH), гидроксид натрия (NaOH) и гидроксид калия (KOH), которые широко используются в различных отраслях промышленности.
Щелочные металлы также проявляют свою активность в реакциях с кислородом. Они быстро окисляются воздухом, образуя оксиды щелочных металлов. Например, литий реагирует с кислородом и образует оксид лития (Li2O), который выделяется в виде белого порошка.
Кроме того, щелочные металлы способны образовывать соли и солевые соединения с другими элементами. Например, хлорид лития (LiCl), нитрат натрия (NaNO3) и сульфат калия (K2SO4) – это некоторые из наиболее известных солей щелочных металлов, которые имеют широкое применение в различных областях науки и промышленности.
Таким образом, химические характеристики щелочных металлов, связанные с их числом валентных электронов, делают их основными и реактивными веществами, широко применяемыми в различных отраслях химии и промышленности.
Щелочные металлы в таблице Менделеева
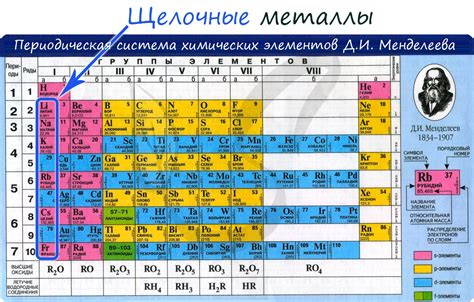
Щелочные металлы – это элементы, которые находятся в первой группе периодической системы химических элементов, в таблице Менделеева. Их общая характеристика – наличие одного валентного электрона. Всего в группе щелочных металлов находятся 6 элементов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каждый щелочный металл имеет свои уникальные свойства. Например, литий – самый легкий из щелочных металлов и самый реактивный; натрий – наиболее распространенный щелочный металл в земной коре; калий – важный элемент для растений и живых организмов; рубидий – используется в научных исследованиях и в электротехнике; цезий – имеет много применений в науке и медицине; франций – самый редкий и самый реактивный щелочный металл.
Щелочные металлы активно взаимодействуют с водой и кислородом, образуя щелочные оксиды и гидроксиды. Они обладают высокой электроотрицательностью и образуют легко растворимые соли. Их соединения широко используются в различных отраслях промышленности, в медицине и в научных исследованиях. Отмечается также их важная роль в биологических процессах и в жизнедеятельности организмов.
Физические свойства щелочных металлов

Щелочные металлы – это элементы 1-й группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. У них имеются следующие физические свойства:
- Щелочные металлы обладают низкой плотностью. Например, плотность лития составляет всего 0,53 г/см³, а у цезия – 1,93 г/см³.
- Они обладают низкой температурой плавления и кипения. У натрия, например, точки плавления и кипения составляют 98 и 883 градуса Цельсия соответственно.
- Щелочные металлы характеризуются мягкостью и пластичностью. Они могут легко гнуться и растягиваться без разрушения.
- Они имеют высокую теплопроводность и электропроводность. Это делает их полезными материалами для различных электротехнических и теплотехнических приложений.
- Щелочные металлы обладают серебристо-белым цветом и благородным блеском на свежей поверхности.
- Они реактивны и быстро окисляются на воздухе. Поэтому их обычно хранят в масле или в инертной среде.
Эти физические свойства делают щелочные металлы полезными во многих областях, включая производство батареек, легких сплавов в авиационной и космической промышленности, а также в изготовлении специальных стекол и керамики.
Число валентных электронов щелочных металлов

Щелочные металлы представляют собой группу элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми химически активными металлами в периодической системе элементов.
Число валентных электронов у щелочных металлов определяется их электронной конфигурацией. Все щелочные металлы имеют один валентный электрон в своей внешней энергетической оболочке. Это делает их очень реактивными и подверженными легким окислительным ионизационным процессам.
Валентные электроны щелочных металлов играют важную роль во многих химических реакциях. Их наличие позволяет щелочным металлам образовывать ионы с однозарядным положительным зарядом, когда они реагируют с другими элементами. Это также делает щелочные металлы хорошими проводниками электричества и тепла.
Важно отметить, что франций (Fr) является самым редким и радиоактивным щелочным металлом. У него также один валентный электрон, но из-за своей нестабильности и короткой полувремени выхода из радиоактивного распада, его химические свойства сложно изучить в лабораторных условиях.
Определение валентности щелочных металлов
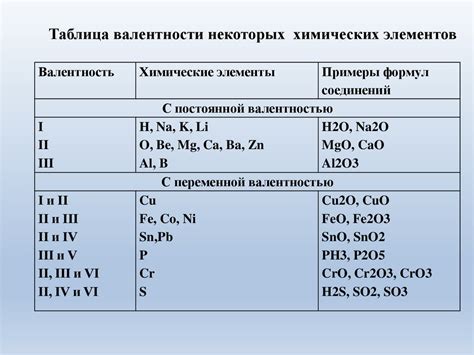
Валентность – это количество свободных электронов в внешней электронной оболочке атома химического элемента. У щелочных металлов валентность всегда равна единице.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., имеют одну свободную электрону в своей внешней электронной оболочке, что делает их очень реактивными и легко переходящими в ионное состояние. Эти металлы стремятся отдать свой валентный электрон, чтобы достигнуть стабильности, образуя положительно заряженные ионы.
Валентность щелочных металлов определяется из расположения элементов в периодической таблице Менделеева. Они находятся в первой группе, что указывает на наличие одного валентного электрона. Таким образом, легко определить валентность щелочных металлов, и это свойство позволяет им образовывать соли и сплавы, активно взаимодействовать с другими элементами и участвовать во множестве химических реакций.
Из-за высокой валентности щелочные металлы обладают такими свойствами, как большая реакционная способность, горючесть, а также способность образовывать щелочные растворы при диссоциации в воде.
Вопрос-ответ

Какие щелочные металлы существуют?
Существует 6 щелочных металлов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Сколько валентных электронов имеют щелочные металлы?
Все щелочные металлы имеют только один валентный электрон, что делает их очень реактивными.
Почему щелочные металлы такие реактивные?
Щелочные металлы имеют только один валентный электрон, который они готовы отдать другим элементам, чтобы достичь стабильной электронной конфигурации. Это делает их очень реактивными и способными образовывать соединения с другими элементами.
Какие свойства имеют щелочные металлы?
Щелочные металлы отличаются мягкостью, низкой плотностью, низкой температурой плавления и кипения. Они также хорошо проводят тепло и электричество. Кроме того, они очень реактивны и легко реагируют с кислородом и водой.
Какие соединения образуют щелочные металлы?
Щелочные металлы образуют соединения с различными элементами, включая кислород, водород, халогены и другие металлы. Например, они образуют оксиды, гидроксиды, хлориды, фториды и другие соединения, которые широко используются в различных отраслях промышленности и науки.
