Атомы металлов представляют собой особый тип атомов, отличающихся от атомов других элементов своими уникальными особенностями строения. В основе строения атомов металлов лежит особый тип связи между атомами, называемый металлической связью.
Металлическая связь возникает благодаря особенностям электронной структуры атомов металла. Атом металла имеет ядро, состоящее из протонов и нейтронов, а вокруг ядра обращаются электроны. Важной особенностью атома металла является наличие свободных электронов, которые могут передвигаться по металлической решетке. Они не принадлежат ни одному конкретному атому, а образуют электронное облако, распределенное по всей металлической решетке.
Металлическая связь обусловливает ряд особенностей строения атомов металла. Во-первых, атомы металла обладают высокой плотностью заряда, так как электроны в металлической связи плотно упакованы вокруг ядра. Во-вторых, атомы металла образуют устойчивую металлическую решетку, где каждый атом соединен с несколькими соседними атомами металла через общие электроны. Это позволяет металлам обладать высокой прочностью и теплопроводностью.
Особенности строения атомов металла играют важную роль в их свойствах и способности проводить электрический ток. Они объясняют такие свойства металлов, как пластичность, эластичность, деформируемость и способность к образованию сплавов. Поэтому изучение строения атомов металла является важным аспектом в сфере материаловедения и технологии производства металлических материалов и изделий.
Устройство атома металла
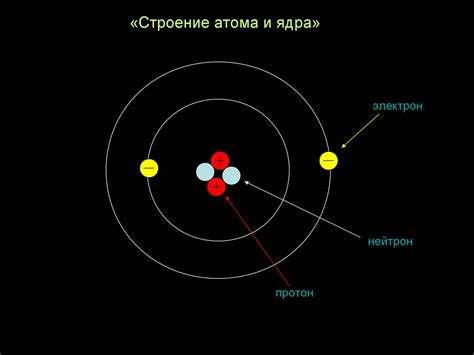
Атом металла представляет собой электрически нейтральную систему, состоящую из двух компонентов: ядра и оболочки. Ядро атома металла содержит нейтроны и протоны, которые образуют его основную массу и положительный заряд. Оболочка состоит из электронов, которые обращаются по определенным орбитам вокруг ядра.
Для металлических элементов характерно большое количество электронов в оболочке, что делает их хорошими проводниками электричества и тепла. Каждая орбита (энергетический уровень) может вмещать определенное количество электронов. Самые близкие к ядру орбиты могут содержать от 2 до 8 электронов, а более отдаленные от ядра орбиты могут вмещать гораздо больше электронов.
Протоны, находящиеся в ядре атома металла, имеют положительный заряд, а электроны находятся в орбитах вокруг него и имеют отрицательный заряд. Этот противоположный заряд создает притяжение между ядром и электронами, что позволяет атому металла оставаться электрически нейтральным.
Оболочка атома металла имеет несколько энергетических уровней, обозначаемых буквами K, L, M, N и т.д. Каждый энергетический уровень содержит свои подуровни, обозначаемые буквами s, p, d, f и т.д. На каждом подуровне могут находиться не более определенного количества электронов.
Таким образом, устройство атома металла характеризуется наличием ядра с протонами и нейтронами, а также оболочкой, содержащей электроны, движущиеся по орбитам вокруг ядра. Это устройство обуславливает особенности физических и химических свойств металлов.
Основные части атома металла

Атом металла состоит из трех основных частей: ядра, электронной оболочки и электронов. Ядро атома металла находится в центре и содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда.
Электронная оболочка окружает ядро и состоит из энергетических уровней или электронных орбиталей. Эти уровни имеют различные энергии и могут содержать разное количество электронов. Наиболее близкий к ядру уровень называется первым энергетическим уровнем или K-орбиталем, а наиболее удаленный – последним или внешним уровнем.
Электроны представляют собой заряженные частицы, движущиеся по орбиталям вокруг ядра атома металла. Количество электронов в атоме определяет его зарядовое состояние. Обычно металлы имеют низкую электронную конфигурацию, то есть имеют малое количество электронов на внешнем энергетическом уровне.
Электронная оболочка атома металла
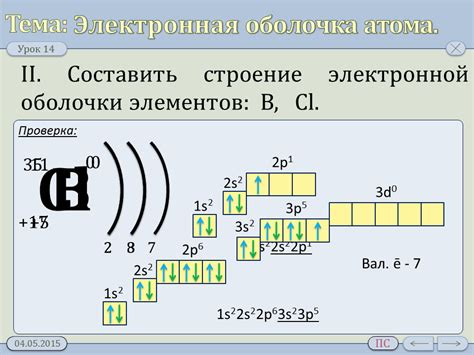
Электронная оболочка атома металла - это наружный слой атома, который содержит электроны и определяет его химические и физические свойства. Оболочка состоит из нескольких энергетических уровней, на которых находятся электроны. Количество энергетических уровней и электронов на каждом из них зависит от атомного номера металла.
На первом энергетическом уровне находится не более 2 электронов, на втором - не более 8, а на третьем - не более 18. На каждом уровне электроны располагаются в различных подуровнях, которые обозначаются буквами s, p, d, f. Например, для металла с атомным номером 26 (железо) электроны будут заполнять следующие оболочки: первая - 2 электрона, вторая - 8 электронов, третья - 14 электронов (3s2 3p6 4s2 3d6).
Электроны в оболочке атома металла взаимодействуют с электронами других атомов, а также с внешними воздействиями, что определяет их химическую реактивность и свойства. Металлы обычно располагаются слева от периодической системы элементов и отдают электроны при взаимодействии с другими элементами. Это связано с тем, что атомы металлов стремятся достичь более устойчивого энергетического состояния, отдавая электроны и образуя положительно заряженные ионы.
Знание строения электронной оболочки атома металла позволяет установить его свойства, такие как отношение к кислороду, проводимость электричества и тепла, магнитные свойства и другие. Кроме того, понимание электронной структуры атома металла является важным элементом для объяснения его химических реакций и использования в различных отраслях промышленности, включая металлургию и электротехнику.
Ядро атома металла
Ядро атома металла является его центральной частью и содержит большую часть массы атома. Оно состоит из протонов и нейтронов, называемых нуклонами. Протоны обладают положительным зарядом, а нейтроны не имеют заряда. Вместе они создают положительно заряженное ядро, которое притягивает отрицательно заряженные электроны.
Число протонов в ядре определяет химические свойства атома и называется атомным номером. Оно также определяет положительный заряд ядра, который компенсируется равным по величине отрицательным зарядом электронов. Количество нейтронов в ядре может варьироваться и определяет изотоп атома металла.
Ядро атома металла имеет очень высокую плотность, поэтому оно занимает небольшой объем в сравнении с общим размером атома. Протоны и нейтроны в ядре сильно связаны друг с другом с помощью сильного ядерного взаимодействия, что делает его крайне стабильным.
Характеристики ядра атома металла, такие как его размер и форма, могут быть описаны с помощью различных теорий и моделей, таких как модель Резерфорда и модель Шредингера. Они позволяют лучше понять внутреннюю структуру и свойства ядра атома металла.
Взаимодействие атомов металла
Строение атомов металла имеет свою специфику, которая определяет особенности их взаимодействия. Основу металлической решетки составляют положительно заряженные ядра атомов, называемые катионами, и свободные электроны, которые окружают эти ядра. Такое строение атомов металла обеспечивает специфические свойства этого класса вещества.
Взаимодействие атомов металла основывается на силе притяжения между электронами и катионами. Электроны образуют своего рода "облако", которое окружает катионы и обеспечивает связь между ними. Этот тип взаимодействия называется металлической связью и является одной из ключевых характеристик металлов.
Металлическая связь обладает несколькими особенностями. Она обеспечивает высокую теплопроводность и электропроводность металлов, так как электроны свободно движутся по решетке. Кроме того, металлическая связь обуславливает пластичность и деформируемость металлов - под воздействием внешней силы атомы металла могут смещаться относительно друг друга, что позволяет материалу принимать различные формы.
Важной особенностью взаимодействия атомов металла является их способность образовывать кристаллическую решетку. Кристаллическая структура металлов позволяет им образовывать регулярные и упорядоченные атомные решетки, что придает материалу прочность и устойчивость к разрушению.
Значение особенностей строения атомов металла

Особенности строения атомов металла играют важную роль в его физических и химических свойствах.
Первой особенностью является наличие большого количества электронов на внешней энергетической оболочке. Это позволяет атомам металла легко отдавать или принимать электроны, что влияет на их электропроводность и химическую активность.
Второй особенностью является наличие кристаллической решетки в металлической структуре. Атомы металла расположены в упорядоченном трехмерном массиве, образуя решетку, и это позволяет металлам быть прочными и устойчивыми.
Третьей особенностью является возможность образования ионов. Атомы металла могут потерять или получить электроны, образуя положительно или отрицательно заряженные ионы, что влияет на их способность к образованию соединений.
Также, особенности строения атомов металла определяют их специфические физические свойства, такие как высокая теплопроводность и электропроводность.
В целом, понимание особенностей строения атомов металла позволяет лучше понять и объяснить их химические, физические и механические свойства, что имеет большое значение для промышленных и технологических приложений металлов.
Вопрос-ответ

Какова основная характеристика строения атома металла?
Строение атома металла характеризуется наличием ядра и электронной оболочки. Ядро состоит из протонов и нейтронов, а электронная оболочка содержит электроны, движущиеся по орбитам вокруг ядра.
Каково соотношение числа электронов и протонов в атоме металла?
Число электронов в атоме металла равно числу протонов в ядре. Это соотношение определяет электрическую нейтральность атома и его химические свойства.
Каким образом электроны движутся вокруг ядра атома металла?
Электроны движутся по энергетическим уровням и орбитам вокруг ядра атома металла. Энергетические уровни представляют собой электронные оболочки, а орбиты - разрешенные траектории для движения электронов.
Какие еще частицы содержит атом металла помимо протонов и электронов?
Помимо протонов и электронов, атом металла также содержит нейтроны в своем ядре. Нейтроны не обладают зарядом и служат для удержания протонов в ядре и поддержания его стабильности.
