Электронная конфигурация атома - это способ представления распределения электронов в энергетических уровнях и подуровнях атома. Она описывает, сколько электронов находится в каждом энергетическом уровне и как они распределены по подуровням. Электронные конфигурации являются важным свойством атомов, поскольку они определяют их химическое поведение и связи с другими атомами.
Металлы - это класс элементов, которые обладают способностью проводить тепло и электричество, имеют блестящую поверхность и обычно твёрдые при комнатной температуре. В периодической системе элементов большинство металлов находится слева от линии, разделяющей металлы и неметаллы. Металлы часто обладают высокой электропроводностью и обычно имеют низкую электроотрицательность.
Металлы имеют различные электронные конфигурации, которые определяют их химические и физические свойства. Например, электронная конфигурация атома кислорода (O) - 1s22s22p4, тогда как электронная конфигурация атома железа (Fe) - 1s22s22p63s23p64s23d6. В данной статье мы рассмотрим электронные конфигурации атомов металлов, в которых первый энергетический уровень заполнен до 1s2, второй до 2s2 и 2p1.
Электронные конфигурации
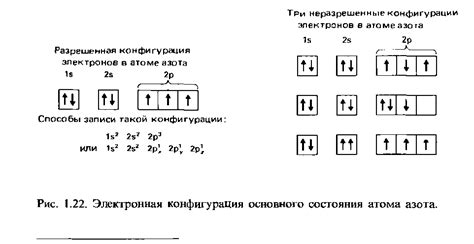
Электронная конфигурация атома металла позволяет описать распределение электронов в его энергетических уровнях и подуровнях. Она определяется количеством электронов в каждом энергетическом уровне и их распределением по подуровням с учетом правил заполнения.
Металлы - это элементы, расположенные слева от периодической системы химических элементов. У них характерными свойствами являются отдельные электроны, которые отвечают за проводимость электричества и тепла. Эти свободные электроны сильно влияют на электронную конфигурацию металлов.
В электронных конфигурациях атомов металлов обычно первым записывается электронная конфигурация закрытых оболочек внутреннего электронного слоя, а затем конфигурация электронов во внешнем рабочем слое. Внешний электронный слой, также называемый валентным слоем, играет важную роль в химических реакциях и определяет химические свойства металла.
Для примера рассмотрим конфигурацию атома натрия (Na), который имеет 11 электронов. Первые 10 электронов занимают энергетические уровни 1s22s22p63s1, а последний электрон занимает энергетический уровень 3s. Таким образом, электронная конфигурация атома натрия будет выглядеть как [Ne]3s1, где [Ne] - обозначает замкнутую оболочку.
Атомы металлов
Металлы являются одной из основных групп химических элементов. Они обладают хорошей теплопроводностью, электропроводностью и металлическим блеском. Атомы металлов обладают специфическими электронными конфигурациями.
Одной из характерных особенностей атомов металлов является наличие относительно небольшого количества электронов в внешней энергетической оболочке. Именно эти электроны определяют химические свойства металлов. Обычно в внешней оболочке металла находится от 1 до 3 электронов. Например, у атомов меди в внешней оболочке находится 1 электрон, а у атомов цинка - 2 электрона.
Также стоит отметить, что атомы металлов имеют положительный заряд ядра, что делает их активными в химических реакциях. Взаимодействуя с другими атомами, атомы металлов могут отдавать свои электроны и образовывать положительные ионы. Например, ионы натрия Na+ имеют на один электрон меньше, чем атом натрия.
В итоге, атомы металлов обладают способностью образовывать между собой металлические связи и образовывать кристаллические структуры. За счет этого металлы обладают хорошей пластичностью и прочностью, что делает их важными материалами в промышленности и строительстве.
Субуровень "s" в электронных конфигурациях атомов металлов 1s22s22p1
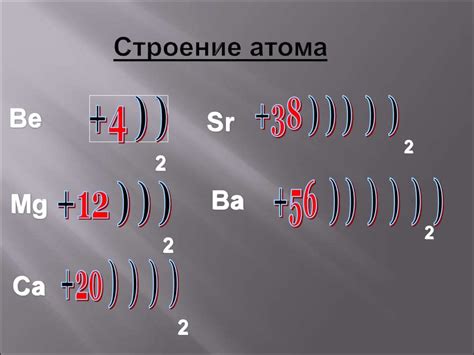
Субуровень "s" является одним из типов субуровней электронных оболочек атомов металлов. В нем находятся "s-электроны", которые обладают особым магнитным моментом и участвуют в формировании химических связей и свойств металлов.
В электронной конфигурации атомов металлов субуровень "s" обычно заполняется после заполнения предыдущих субуровней, таких как "1s" и "2s". Например, электронная конфигурация атома натрия (Na) состоит из снятия электронов сортировкой на "1s22s22p6", а затем заполнением субуровня "3s" одним электроном, что дает итоговую конфигурацию "1s22s22p63s1".
В субуровне "s" наибольшая энергия относительно других субуровней, что позволяет "s-электронам" участвовать в реакциях и образовании связей с другими атомами. "S-электроны" также могут образовывать электронные пары и располагаться в междуатомных пространствах, что влияет на физические свойства металлов.
Конфигурация субуровня "s" в электронных оболочках атомов металлов может быть представлена в виде таблицы:
| Атом | Конфигурация "s" |
|---|---|
| Натрий (Na) | 1s22s22p63s1 |
| Магний (Mg) | 1s22s22p63s2 |
| Кальций (Ca) | 1s22s22p63s2 |
Таким образом, субуровень "s" играет важную роль в определении химических и физических свойств атомов металлов и их способности образовывать связи с другими атомами.
Сверхточный спектральный анализ и последствия для понимания электронной конфигурации атомов металлов

Сверхточный спектральный анализ - это один из методов изучения электронной структуры атомов. Этот метод позволяет определить энергетические уровни и электронные конфигурации атомов металлов. Результаты такого анализа имеют большое практическое значение в различных областях науки и техники, таких как материаловедение, каталитическая химия, электрохимия и т. д.
Различные металлы имеют различные электронные конфигурации, которые определяют их физические и химические свойства. Например, атом металла может иметь сферическую симметрию своей электронной оболочки, но также могут присутствовать и полярные эффекты, связанные с наличием незаполненных d или f орбиталей.
Особенно интересным является эффект, называемый "странные металлы". Данный термин применяется к материалам, в которых наблюдается неподвижное состояние электронов вблизи Фермиевского уровня. Эти материалы обладают множеством необычных свойств и пока остаются объектом исследований. Сверхточный спектральный анализ позволяет изучать электронную конфигурацию атомов таких странных металлов и может привести к новым открытиям в фундаментальной физике и материаловедении.
Вывод: Сверхточный спектральный анализ позволяет раскрыть тайны электронных конфигураций атомов металлов, провести более глубокий анализ и понять связь между электронной структурой и свойствами металлов. Это важный инструмент для исследования материалов и создания новых технологий в различных отраслях науки и техники.
Электронные конфигурации атомов металлов

Атомы металлов имеют особенность в своей электронной конфигурации - наличие одного электрона в оболочке p1. Это означает, что в атоме металла есть два электрона в s-подуровне и один электрон в p-подуровне. Такая конфигурация важна для определения химических свойств металлов.
Электронная конфигурация атома металла с p1 подуровнем может быть представлена следующим образом: 1s2 2s2 2p1. Это означает, что первая оболочка содержит два электрона (1s2), вторая оболочка содержит два электрона (2s2) и один электрон находится в p-подуровне (2p1).
Электронное строение атома металла определяет его химические свойства и влияет на его взаимодействие с другими атомами. Например, электрон p1 может быть передан другому атому, образуя положительный ион металла с пустым p-подуровнем. Это позволяет металлу образовывать ионы и подвергаться превращениям в различных химических реакциях.
Классификация металлов на основе электронной конфигурации является одним из способов описания и изучения их свойств. Электронная конфигурация с p1 подуровнем характеризует металлы, такие как алюминий (Al), галлий (Ga) и индий (In), и позволяет понять их поведение и реакционную способность в химических реакциях.
Вопрос-ответ

Какие элементы металлической группы имеют электронную конфигурацию 1s22s22p1?
Элементы, которые имеют электронную конфигурацию 1s22s22p1, принадлежат к первой группе периодической системы и включают в себя металлы такие как литий (Li) и натрий (Na).
Что означает электронная конфигурация 1s22s22p1?
Электронная конфигурация 1s22s22p1 означает, что атом содержит 1 электрон в своей внешней энергетической оболочке, которая состоит из двух электронов в s-орбитали и двух электронов в p-орбитали. Такая конфигурация обычно характерна для атомов первой группы периодической системы, таких как литий и натрий.
