Металлы – это группа химических элементов, которые обладают рядом особенных химических свойств. Они имеют высокую электропроводность, благодаря свободным электронам в их кристаллической решетке. Металлы являются отличными проводниками тепла, так как электроны могут перемещаться с высокой скоростью и передавать энергию другим частицам. Кроме того, металлы часто характеризуются блестящей поверхностью, так как свободные электроны способны отражать свет. Среди наиболее известных металлов можно назвать железо, алюминий, медь, свинец и золото.
Одной из основных особенностей металлов является их способность образовывать положительные ионы. Это происходит во время химических реакций, когда металлы отдают свои внешние электроны и переходят в ионное состояние. Такой процесс называется окислением. В результате таких реакций, металлы часто образуют соли, которые встречаются в различных соединениях и минералах.
Одним из примеров химического свойства металлов является их реакция с кислородом. Многие металлы способны окисляться воздухом и образовывать окислы. Например, железо при взаимодействии с кислородом образует ржавчину, что делает металл менее прочным и надежным. С другой стороны, алюминий при окислении образует оксидную пленку, которая защищает его от дальнейшей коррозии.
Химические свойства металлов играют важную роль во многих отраслях промышленности и технологий. Например, медь широко используется в электротехнике и электронике из-за своей высокой электропроводности. Железо является основным компонентом стали, которая используется для строительства и производства различных изделий. Исследование химических свойств металлов позволяет улучшать и создавать новые материалы с уникальными свойствами.
Важные свойства металлов
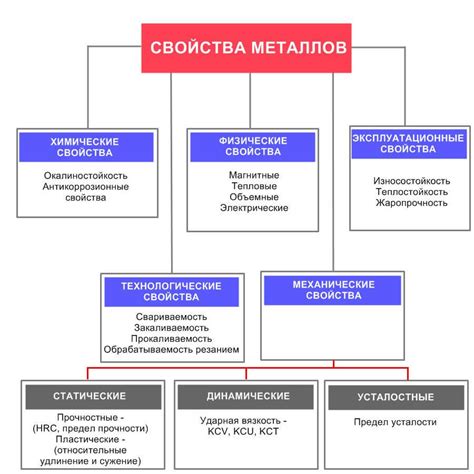
1. Проводимость электричества и тепла. Металлы обладают высокой проводимостью электричества и тепла. Именно благодаря этим свойствам металлы широко используются в электротехнике и теплообменных устройствах.
2. Пластичность и деформируемость. Металлы могут подвергаться пластической деформации без разрушения своей структуры. Благодаря этому свойству металлы легко обрабатываются и могут принимать различные формы при литье, ковке или прокатке.
3. Химическая реактивность. Металлы способны вступать в химические реакции с различными веществами. Некоторые металлы реагируют с водой или кислородом, образуя оксиды и гидроксиды. Другие металлы могут вступать в реакции с кислотами или щелочами.
4. Окрашенность. Некоторые металлы имеют специфическую окраску, которая отличается от окраски других веществ. Например, медь имеет красновато-коричневую окраску, железо - серую или серебристую, а алюминий - серебристо-белую.
5. Восстановительные свойства. Металлы могут восстанавливать свою первоначальную форму и свойства после деформации или воздействия различных факторов. Это свойство делает металлы прочными и стойкими к внешним воздействиям.
Физические свойства металлов
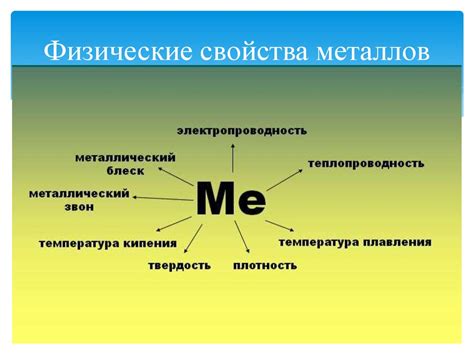
Металлы обладают рядом характерных физических свойств, которые отличают их от других материалов. Одно из основных физических свойств металлов - это высокая теплопроводность. Это означает, что металлы отлично проводят тепло и способны быстро распределить его по своему объему. Благодаря этому свойству металлы широко используются в производстве нагревательных элементов и систем отопления.
Еще одно важное физическое свойство металлов - высокая электропроводность. Они способны передавать электрический ток без значительных потерь. Эта особенность металлов позволяет использовать их в производстве электронных устройств, проводов и кабелей.
Металлы также обладают высокой пластичностью и формоизменяемостью. Они легко поддаются деформации и способны принимать различные формы при обработке. Это позволяет создавать сложные конструкции и изделия из металлов, а также обеспечивает возможность повторной переработки и утилизации металлических материалов.
Еще одно характерное физическое свойство металлов - это высокая плотность. Металлы обладают большим весом по сравнению с другими материалами при равном объеме. Это свойство позволяет использовать металлы в качестве строительного материала для создания прочных, устойчивых и надежных конструкций.
Электронные свойства

Металлы обладают характеристиками, которые связаны с движением электронов в их структуре. Электронные свойства металлов определяют их способность проводить электрический ток, электропроводность и термопроводность.
В металлической структуре электроны находятся в валентных и свободных энергетических состояниях. Валентные электроны заняты внутренними энергетическими уровнями и образуют электронные облака вокруг ядер атомов металла.
Свободные электроны представляют собой электроны, которые подвижны внутри металла. Они обладают высокими энергиями и могут свободно перемещаться через структуру металла, предоставляя причину, почему металлы обладают высокой электропроводностью.
Электроны в металлах также обладают свойством формировать связи с другими атомами и формировать молекулы или кристаллическую структуру. Это позволяет металлам образовывать различные соединения с другими элементами и соединениями.
Химические свойства

Металлы обладают уникальными химическими свойствами, которые делают их основой для многих промышленных и технологических процессов. Одна из основных химических особенностей металлов - их способность образовывать ионные соединения. Это связано с их электроотрицательностью: металлы обладают низкой электроотрицательностью и готовы отдавать электроны другим элементам.
Металлы также обладают высокой теплопроводностью и электропроводностью, что делает их ценными для использования в электрических цепях и теплообменниках. Благодаря высокой пластичности и прочности, металлы могут быть легко обработаны и использованы для создания различных конструкций и изделий.
Интересным свойством металлов является их способность реагировать с кислородом воздуха, образуя оксиды. Некоторые металлы, такие как натрий и калий, реагируют даже с водой, образуя гидроксиды и выделяя водород. Оксиды металлов часто используются в качестве катализаторов в различных химических процессах.
Кроме того, металлы могут образовывать сплавы с другими металлами или неметаллами, что позволяет улучшить их свойства. Например, железо может быть сплавлено с углеродом для создания стали, которая обладает высокой прочностью и жесткостью.
Реактивность металлов
Реактивность металлов - это способность металлов взаимодействовать с другими веществами и проявлять химическую активность. Реактивность может быть разной у различных металлов и определяется структурной особенностью их атомов.
Наиболее реактивными металлами являются щелочные металлы, такие как литий, натрий и калий. Они легко соединяются с кислородом, образуя оксиды. Кроме того, они быстро реагируют с водой, образуя щелочную среду и выделяя водород. Щелочные металлы также обладают способностью взаимодействовать с нефтью и газами.
Щелочноземельные металлы, такие как магний и кальций, также обладают высокой реактивностью. Они могут реагировать с водой, хлором и другими активными химическими элементами.
Также существуют металлы, которые обладают низкой реактивностью, например, золото и платина. Они мало взаимодействуют с другими веществами и обладают высокой устойчивостью к окислительным процессам.
Однако реактивность металлов может быть изменена при изменении условий среды, например, при изменении pH или температуры. Также некоторые металлы могут проявлять реактивность только в определенных соединениях или взаимодействовать только с определенными группами веществ.
Примеры металлов и их химические свойства
Железо (Fe) – один из наиболее распространенных металлов Вещественной Земли. Оно обладает высокой термической и электрической проводимостью, что делает его важным материалом для производства проводов и электрических устройств. Кроме того, железо является ключевым компонентом структурных материалов, таких как сталь. Оно также реагирует с водой и кислородом, образуя ржавчину, что делает его уязвимым к коррозии.
Алюминий (Al) – легкий и прочный металл с высокой электропроводностью. Он используется в широком спектре приложений, включая производство авиационных и автомобильных деталей, упаковочных материалов и строительных конструкций. Алюминий обладает хорошей коррозионной стойкостью и реагирует со многими кислотами, но образует защитную оксидную пленку, которая помогает предотвратить дальнейшую коррозию.
Медь (Cu) – блестящий красноватый металл, известный своей высокой теплопроводностью и электропроводностью. Он широко используется для производства электроники, медных проводов, труб и монет. Медь также обладает антимикробными свойствами, благодаря чему используется в медицине для изготовления инструментов и поверхностей, предотвращающих распространение бактерий.
Серебро (Ag) – благородный металл, известный своим высоким блеском и хорошей электропроводностью. Оно широко используется для производства ювелирных изделий, посуды и электронной аппаратуры. Серебро также обладает антимикробными свойствами и часто применяется в медицине для изготовления медицинских препаратов и антисептиков.
Свинец (Pb) – тяжелый мягкий металл, который используется для производства аккумуляторов, покрытий и пулевых пуль. Свинец обладает низкой теплопроводностью и химической инертностью. В организме свинец является ядом и может накапливаться в тканях, вызывая серьезные заболевания.
Цинк (Zn) – белый металл, который используется во многих областях, включая защиту от коррозии, производство батареек, сплавов и лекарств. Цинк обладает химической стойкостью и служит важным компонентом веществ, необходимых для здоровья, таких как ферменты и гормоны.
Вопрос-ответ

Какие основные химические свойства металлов?
Основными химическими свойствами металлов являются высокая электропроводность, металлический блеск, склонность к образованию ионов положительного заряда, способность образовывать сплавы, взаимодействовать с кислородом, кислотами и щелочами. Также металлы обладают высокой пластичностью и теплопроводностью.
Как металлы взаимодействуют с кислородом?
Металлы взаимодействуют с кислородом, образуя оксиды. Например, железо при взаимодействии с кислородом окисляется и образует оксид железа (Fe2O3), который мы называем ржавчиной. Алюминий при окислении образует оксид алюминия (Al2O3), который обладает пленкой, защищающей металл от дальнейшего окисления.
Какие металлы могут взаимодействовать с кислотами?
Многие металлы могут взаимодействовать с кислотами, образуя соли и выделяя водород. Например, натрий (Na) реагирует с соляной кислотой (HCl) и образует хлорид натрия (NaCl) и выделяет водород (H2). Алюминий (Al) взаимодействует с серной кислотой (H2SO4) и образует сульфат алюминия (Al2(SO4)3) и выделяет водород.
Что такое сплавы металлов?
Сплавы металлов - это материалы, состоящие из двух или более металлических элементов. Они обладают различными свойствами, такими как механическая прочность, термическая и электрическая проводимость, устойчивость к коррозии, и используются в различных отраслях промышленности, например, в строительстве, авиации, машиностроении, электронике и других.
Какие примеры металлов можно привести?
Примеры металлов: железо (Fe), алюминий (Al), медь (Cu), свинец (Pb), цинк (Zn), никель (Ni), золото (Au), серебро (Ag), желтый металл (латунь), белый металл (никель-серебро), магний (Mg), кальций (Ca), калий (K), натрий (Na) и многое другое.
