Переменная степень окисления – это характеристика химического элемента, указывающая на количество электронов, которые элемент может отдать или принять в химической реакции. Окиснительное число металла может изменяться в зависимости от условий реакции и окружающей среды.
Однако не все металлы имеют переменную степень окисления. Некоторые металлы, такие как золото и платина, имеют постоянную степень окисления во всех соединениях. Они обычно играют роль катализаторов или кондукторов электричества, и их окиснительное число равно нулю.
В то же время, существует группа металлов, у которых переменная степень окисления. К ним относятся, например, переходные металлы, такие как медь, железо и цинк. Они могут иметь различные окислительные состояния, что позволяет им участвовать в различных химических реакциях и образовывать разнообразные соединения. Например, железо может иметь окиснительное число +2 или +3, в зависимости от условий реакции.
Исследование переменных степеней окисления металлов имеет важное практическое значение для разработки новых материалов и производства различных химических продуктов. Понимание особенностей окиснительных свойств металлов позволяет контролировать реакции и получать желаемые продукты.
В заключение, переменная степень окисления встречается у ряда металлов, прежде всего у переходных металлов. Исследование изменения окиснительного числа металлов является важным направлением в химии и позволяет расширять наши знания об их химических свойствах и возможностях использования.
Способы определения степени окисления металлов

Степень окисления металлов определяет, сколько электронов металл отдает или принимает при образовании химических связей. Определение степени окисления металлов важно для понимания их химической реактивности и способности образовывать соединения.
Одним из способов определения степени окисления металлов является анализ химической формулы соединения, в котором металл содержится. В химической формуле соединения написаны знаки валентности металлов, которые указывают на их степень окисления. Например, в формуле соединения Fe2O3 степень окисления железа составляет +3, так как валентность кислорода равна -2, а сумма степеней окисления всех элементов должна быть равна нулю.
Другим способом определения степени окисления металлов является анализ уравнения реакции, в которой участвуют соединения совместно с металлом. В уравнении реакции указаны коэффициенты перед формулами веществ, которые позволяют определить количество производимых или потребляемых электронов металлом. По изменению степени окисления металла можно определить, сколько электронов он отдаёт или принимает.
Также степень окисления металлов можно определить с использованием таблицы стандартных потенциалов. В этой таблице приведены значения потенциалов окисления и восстановления различных элементов. С помощью данной таблицы можно сравнивать потенциалы окисления и восстановления металлов и определить их степень окисления. Например, если потенциал окисления металла выше, чем потенциал окисления другого металла, то степень окисления первого металла будет выше.
Таким образом, существуют различные способы определения степени окисления металлов, включая анализ химической формулы соединений, уравнений реакций и использование таблицы стандартных потенциалов. Эти методы позволяют более глубоко понять химическую реактивность металлов и их способность образовывать соединения.
Методы определения окислительно-восстановительных свойств

Окислительно-восстановительные свойства металлов определяются с помощью различных методов, которые позволяют определить переменную степень окисления металла.
Один из таких методов - потенциометрия. Этот метод основан на измерении разности потенциалов между электродами, которые находятся в среде, содержащей исследуемый металл. При помощи этого метода можно определить окислительные свойства металла и его способность к восстановлению.
Другим методом является анализ реакций окисления-восстановления, которые происходят при взаимодействии металла с различными веществами. Например, методом титрования можно определить окислительную способность металла, определив количество вещества, которое он способен окислить или восстановить.
Также широко применяются спектральные методы определения окислительно-восстановительных свойств металлов. Они основаны на анализе спектров поглощения или испускания электромагнитного излучения металлом при прохождении через него энергии определенной частоты или длины волны. Это позволяет определить конкретные окислительные состояния металла и его способность к восстановлению в различных условиях.
И наконец, одним из основных методов определения окислительно-восстановительных свойств металлов является использование электрохимических процессов. Этот метод основан на измерении электрических параметров, таких как ток или потенциал, при проведении электрохимической реакции с участием исследуемого металла.
Металлы, обладающие переменной степенью окисления

Некоторые металлы проявляют способность вступать в реакции с кислородом и другими элементами с различными степенями окисления. Это позволяет им образовывать соединения с различными электрическими зарядами. Такие металлы называются металлами с переменной степенью окисления.
Одним из примеров металлов с переменной степенью окисления является железо. Железо может образовывать соединения с двумя основными степенями окисления: двухвалентным железом (Fe2+) и трехвалентным железом (Fe3+). Эти соединения имеют различные свойства и применения в различных областях, таких как медицина, производство стали и электроника.
Еще одним примером металла с переменной степенью окисления является марганец. Марганец может образовывать соединения с тремя основными степенями окисления: двухвалентным (Mn2+), трехвалентным (Mn3+) и семивалентным (Mn7+). Это позволяет марганцу проявлять различные химические и физические свойства, что делает его полезным в различных отраслях, таких как производство стекла и керамики, а также в электропромышленности.
К другим примерам металлов с переменной степенью окисления относятся ванадий, титан, уран и много других. Каждый из этих металлов также способен формировать соединения с различными степенями окисления, что дает им широкий спектр применений в научных и промышленных областях.
В заключение, металлы с переменной степенью окисления представляют собой важный класс веществ, которые имеют различные свойства и применения в различных отраслях. Их способность образовывать соединения с различными степенями окисления делает их полезными во многих химических процессах и технологиях.
Влияние переменной степени окисления на свойства металлов

Переменная степень окисления, или валентность, является одним из важнейших химических свойств металлов. Она определяет количество электронов, которые металл может отдать или принять при участии в химических реакциях.
У различных металлов переменная степень окисления может принимать различные значения. Например, у железа встречаются две основные степени окисления - Fe2+ и Fe3+. Золото может иметь степень окисления +1 или +3. Олово может образовывать ионы Sn2+ и Sn4+. Это всего лишь несколько примеров из множества возможных окислительных степеней металлов.
Переменная степень окисления играет важную роль в определении химической активности металлов. Металлы с различными степенями окисления обладают разными свойствами и могут проявлять различную реакционную способность.
Например, металлы с наиболее низкими степенями окисления, такими как Cu+ и Ag+, обычно обладают высокой активностью и хорошей растворимостью в воде. Некоторые металлы со средними степенями окисления, например, Cr3+ или Fe3+, обладают способностью образовывать стабильные соединения и использоваться в качестве катализаторов.
С другой стороны, металлы с высокими степенями окисления, такими как Mn7+ или Ru8+, часто являются сильными окислителями и могут проявлять агрессивные свойства в химических реакциях.
Важно отметить, что переменная степень окисления металлов может изменяться в различных условиях. Это позволяет использовать металлы с разными окислительными степенями в различных химических процессах и применениях, например, в электрохимии, катализе и производстве лекарственных препаратов.
В целом, переменная степень окисления является одной из важнейших характеристик металлов, которая определяет их способность участвовать в химических реакциях и определяет их химические свойства и реакционную способность.
Практическое применение переменной степени окисления металлов

Переменная степень окисления металлов является важным понятием в химии, которое имеет практическое применение в разных областях. Различные металлы могут иметь различные степени окисления, что открывает возможности для разнообразных реакций и процессов.
Одним из практических применений переменной степени окисления металлов является её использование при определении концентрации металлов в растворах. Окислительно-восстановительные реакции, основанные на изменении степени окисления металла, позволяют проводить точные и быстрые анализы металлических ионов в различных материалах.
Переменная степень окисления металлов также находит применение в электрохимии. Металлы с различными степенями окисления могут быть использованы в электрохимических процессах, таких как гальванические элементы или аккумуляторы. Именно изменение степени окисления металла обеспечивает протекание электрохимических реакций и создание энергии.
Кроме того, переменная степень окисления металлов имеет значение в производстве различных материалов. Например, стали с разными степенями окисления железа обладают различными свойствами и могут использоваться в разных отраслях, включая строительство, производство автомобилей и машиностроение.
В целом, знание и понимание переменной степени окисления металлов позволяет ученным и инженерам применять эти материалы и реакции на практике, создавая новые материалы, проводя анализы и оптимизируя электрохимические процессы. Понимание свойств и возможностей металлов с разными степенями окисления открывает широкие перспективы для развития научных и промышленных отраслей.
Польза переменной степени окисления для химических реакций

Переменная степень окисления играет важную роль в химических реакциях, позволяя определить, какие металлы способны переходить от одной степени окисления к другой. Это свойство очень полезно при проведении различных химических превращений и синтезе веществ.
Переменная степень окисления металла определяется числом, которое показывает, сколько электронов этот металл может потерять или получить во время реакции. Это значит, что металлы с переменной степенью окисления обладают способностью претерпевать окислительно-восстановительные реакции, где они могут менять свою степень окисления.
Переменная степень окисления позволяет ученым исследовать различные кислотно-основные реакции, а также процессы окисления и восстановления металлов. Эти реакции являются основой для создания новых веществ и материалов с определенными свойствами. Например, на основе металлов с переменной степенью окисления можно создать специальные катализаторы, которые используются в процессах синтеза и очистки веществ.
Польза переменной степени окисления для химических реакций заключается также в возможности управлять процессами синтеза и разложения веществ. Зная, какие металлы могут изменять свою степень окисления, можно контролировать растворимость и реакционную активность веществ. Это позволяет эффективно проводить множество химических превращений и получать нужные продукты с высокой степенью чистоты и качества.
Таким образом, переменная степень окисления металлов играет значительную роль в химических реакциях, обеспечивая ученым глубокое понимание процессов взаимодействия веществ и возможность создания новых материалов с нужными свойствами. Это свойство металлов открывает широкие перспективы в различных сферах науки и технологии, включая катализ и синтез органических соединений.
Переходные металлы и их переменная степень окисления
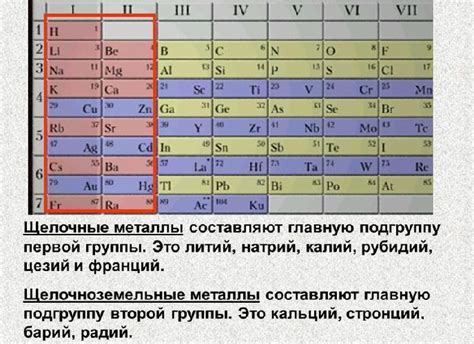
Переходные металлы - группа элементов, которая включает в себя металлы с атомными числами от 21 до 30, а также 39 до 48 и 57 до 80. Они являются наиболее распространенными металлами на земле и имеют многочисленные применения в различных отраслях промышленности.
Одной из характеристик переходных металлов является их переменная степень окисления. Это означает, что эти металлы могут образовывать соединения с разными степенями окисления, в зависимости от условий реакции.
Примером такой переменной степени окисления является железо, которое может образовывать соединения с окислением +2 и +3. Например, FeO и Fe2O3. В первом случае железо имеет степень окисления +2, а во втором - +3.
Также многие другие переходные металлы имеют переменную степень окисления. Например, марганец может образовывать соединения с окислением +2, +3, +4 и +7. Серебро может иметь степень окисления +1 или +2.
Переменная степень окисления переходных металлов обусловлена особенностями электронной конфигурации атомов этих элементов. Изменение степени окисления позволяет переходным металлам образовывать разнообразные соединения и участвовать в различных химических реакциях.
Потенциал редокс-реакций у металлов
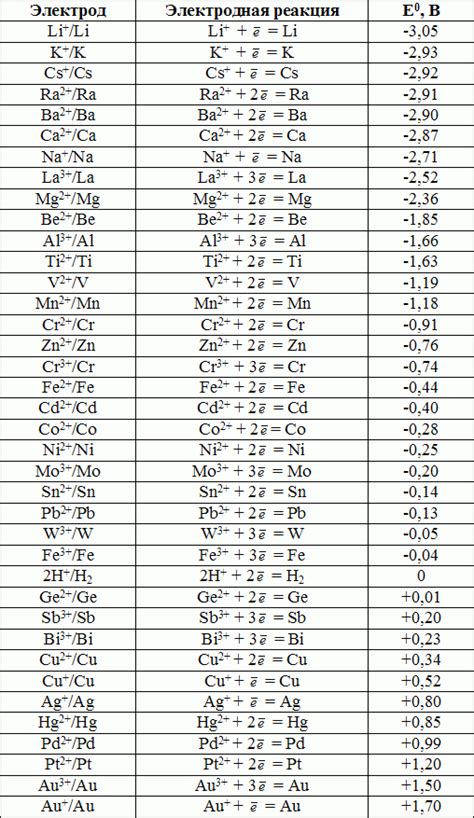
Потенциал редокс-реакций – это важная характеристика, которая позволяет определить способность металлов переходить в различные степени окисления при взаимодействии с окислителями и восстановителями. От данного параметра зависит возможность проведения электрохимических реакций и получение электроэнергии.
У различных металлов переменная степень окисления обусловлена особенностями строения и расположения электронных оболочек атомов. Благодаря этим особенностям металлы могут вступать в различные реакции, меняя свою степень окисления.
Наиболее известными металлами, у которых переменная степень окисления, являются железо, медь, свинец, марганец и некоторые другие. Железо, например, может иметь степень окисления +2 и +3, что обусловлено наличием двух вариантов электронного строения атома железа. Это позволяет железу участвовать в различных реакциях с окислителями и восстановителями.
Значение потенциала редокс-реакций у металлов определяется разницей энергии между исходным и конечным состояниями атомов металла. Чем больше разница энергии, тем более активен металл и больше его потенциал редокс-реакций.
Вопрос-ответ

Какие металлы могут иметь переменную степень окисления?
Переменная степень окисления свойственна многим металлам, включая такие, как железо, медь, марганец, кобальт, хром и другие. Это означает, что эти металлы могут образовывать соединения с различными окисными числами.
Почему некоторые металлы имеют переменную степень окисления?
Переменная степень окисления у металлов обусловлена наличием свободных электронов в их валентной оболочке, что позволяет им образовывать соединения с разными окисными числами. Это зависит от условий реакции и окружающей среды.
Какие свойства металлов обуславливают их переменную степень окисления?
Одним из ключевых свойств металлов, влияющих на их переменную степень окисления, является наличие нескольких валентностей - способность образовывать активные положительные ионы разных зарядов. Это связано с особенностями строения и электронной конфигурации металла.
