Реакция твердых кислотных оксидов с основными оксидами активных металлов является одним из важнейших процессов в химии неорганических соединений. В результате таких реакций образуются соли, основных и кислотных свойств которых определяют химическую активность и использование данных соединений в различных областях промышленности и научных исследований.
Кислотные оксиды, также известные как ангидриды, представляют собой соединения, в которых кислород связан с другими элементами, например, серой или азотом. Они обладают выраженными кислотными свойствами и способны образовывать соли при реакции с основными оксидами. Основные оксиды, в свою очередь, представляют собой соединения металла с кислородом, которые обладают основными свойствами и способны образовывать соли при реакции с кислотными оксидами.
В результате реакции кислотного оксида с основным оксидом происходит образование соли и воды. Например, реакция серного ангидрида (SO3) с оксидом кальция (CaO) приводит к образованию сернокислого кальция (CaSO4) и воды. Также возможны реакции с образованием кислотных оксидных гидратов, которые являются производными от кислотных оксидов и участвуют в дальнейших химических процессах.
Твердые кислотные оксиды
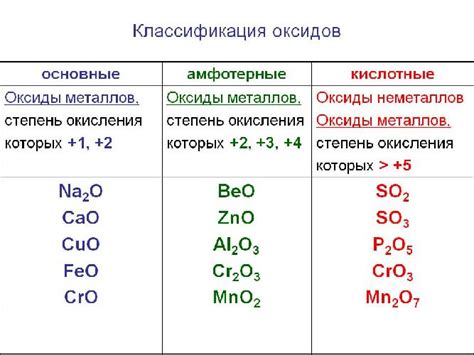
Твердые кислотные оксиды – это химические соединения, состоящие из оксида и кислоты. Они обладают кислотными свойствами и могут растворяться в воде, реагируя с ней и образуя кислотные растворы.
Одним из примеров твердого кислотного оксида является двуокись углерода (углекислый газ). Этот газ образуется при сгорании угля или старения органических веществ. Он хорошо растворяется в воде, образуя угольную кислоту. Угольная кислота имеет свойства слабой кислоты и используется в химической промышленности, в медицине и других областях.
Твердые кислотные оксиды могут быть растворимыми или нерастворимыми в воде. Растворимость зависит от структуры и свойств соединения. Нерастворимые оксиды образуют осадок при взаимодействии с водой, например, оксиды металлов, такие как алюминий, железо, медь. Они обладают кислотными свойствами и используются в различных сферах, включая строительство и производство различных материалов.
Определение и свойства

Твердые кислотные оксиды - это оксиды, которые образуются при соединении кислорода с активными неметаллами. Они проявляют кислотные свойства при взаимодействии с водой, образуя кислоты. Твердые кислотные оксиды обычно имеют высокую температуру плавления и большую твердость.
Свойства твердых кислотных оксидов определяются их химическим составом и структурой кристаллической решетки. Они обладают высокой степенью электроотрицательности, что связано с высоким контентом кислорода в их составе.
Твердые кислотные оксиды могут реагировать с основными оксидами активных металлов, что приводит к образованию солей. Реакция происходит с выделением тепла и может сопровождаться образованием газа.
Некоторые известные твердые кислотные оксиды включают оксиды серы (SO2, SO3), азота (NO2, NO3), фосфора (P2O5), хлора (Cl2O7) и многие другие. Они играют важную роль в различных химических процессах и используются в промышленности для получения различных соединений и материалов.
Основные оксиды активных металлов
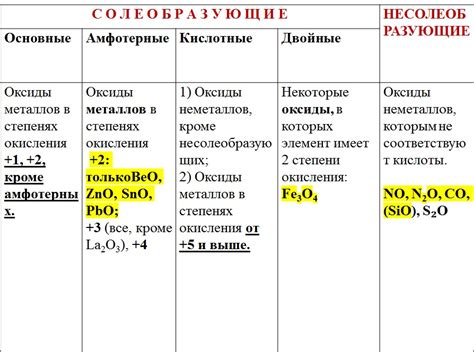
Основные оксиды активных металлов представляют собой соединения, образующиеся при окислении металлов кислородом. Эти оксиды характеризуются высокой основностью и способностью образовывать щелочные растворы.
Активные металлы, такие как натрий, калий, кальций и другие, реагируют с кислородом воздуха, образуя основные оксиды. Например, натрий реагирует с кислородом и образует оксид натрия (Na2O), который представляет собой белый кристаллический порошок. Оксид калия (K2O) и оксид кальция (CaO) также являются примерами основных оксидов.
Основные оксиды активных металлов обладают высокой растворимостью в воде и реагируют с ней, образуя гидроксиды. Например, оксид натрия реагирует с водой и образует гидроксид натрия (NaOH), который широко используется в химической промышленности.
Основные оксиды активных металлов имеют важное применение в различных отраслях науки и техники. Они используются в производстве стекла, керамики, щелочей, удобрений и других химических веществ. Кроме того, многие основные оксиды активных металлов являются основой для производства основных катализаторов, используемых в промышленных процессах.
Определение и свойства

Твердые кислотные оксиды – это неорганические соединения, обладающие свойствами кислотных оксидов и находящиеся в твердом состоянии при обычных условиях.
Такие соединения обычно образуются при реакции активных металлов с кислородом воздуха при высоких температурах. Твердые кислотные оксиды обычно имеют кристаллическую структуру и обладают высокими температурами плавления и кипения.
Основные оксиды активных металлов также являются неорганическими соединениями, обладающими сильно щелочными свойствами и находящимися в твердом состоянии при обычных условиях. Они образуются при реакции активных металлов с кислотами или солью металлов.
Реакция между твердыми кислотными оксидами и основными оксидами активных металлов приводит к образованию соли и воды. Это называется реакцией нейтрализации и является типичным примером химической реакции. Такие реакции практически всегда протекают с выделением тепла, так как нейтрализация сопровождается освобождением энергии. Однако, иногда могут происходить и экзотермические реакции, когда внешняя энергия требуется для их протекания.
Степень окисления
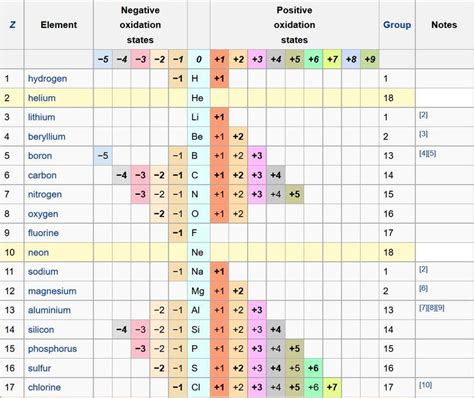
Степень окисления – это числовое значение, которое отражает изменение электронного состояния атома при его участии в химической реакции. Для определения степени окисления атома необходимо знать его электроотрицательность и число электронов в его валентной оболочке.
В контексте реакции твердых кислотных оксидов с основными оксидами активных металлов степень окисления играет важную роль. При взаимодействии кислотных оксидов с основными оксидами происходит образование солей и воды. Кислотные оксиды, такие как оксид серы (SO3) или оксид азота (NO2), имеют положительную степень окисления, так как при реакции они передают электроны основному оксиду.
Основные оксиды активных металлов, например оксид натрия (Na2O) или оксид калия (K2O), характеризуются отрицательной степенью окисления, так как они принимают электроны от кислотного оксида. Образование солей и воды в результате реакции позволяет компенсировать изменение электронного состояния атомов и достижение более стабильной химической связи.
Образование солей
Реакции твердых кислотных оксидов с основными оксидами активных металлов приводят к образованию солей – химических соединений, состоящих из катионов металла и анионов кислотного остатка.
Процесс образования солей начинается с растворения кислотного оксида в воде. При этом оксид образует соединение с водой, образуя соответствующую кислоту. Затем активный металл, содержащийся в основном оксиде, реагирует с образовавшейся кислотой. В результате реакции образуется соль и выделяется вода.
Образование солей возможно только при условии, что кислотный оксид и основной оксид обладают достаточной реакционной способностью. При этом образующаяся соль должна быть стабильной и растворимой в воде.
Соли широко используются во многих областях науки и промышленности. Они являются основными строительными блоками многих материалов и используются в процессе производства металлов, стекла, керамики и других веществ. Кроме того, соли широко используются в пищевой промышленности, медицине и стоматологии, а также в процессе очистки воды и производства удобрений.
Избирательное взаимодействие

Реакция твердых кислотных оксидов с основными оксидами активных металлов происходит в результате избирательного взаимодействия между ионами кислотного оксида и ионами основного оксида. Это взаимодействие зависит от разнообразных факторов, таких как электроотрицательность, ионный радиус и степень окисления элементов в соединении.
Наиболее распространенной формой избирательного взаимодействия является образование солей, которые могут быть кислотными или основными. Если соль является кислотной, то главным компонентом будет ион кислоты, а если соль является основной, то главным компонентом будет ион основания. Это связано с различными способностями кислотных и основных оксидов в образовании солей и их растворимости в воде или других растворителях.
Избирательное взаимодействие может также приводить к образованию нейтральных соединений, когда ионы кислотного оксида и ионы основного оксида реагируют один к одному. Это происходит при определенных условиях, таких как правильное соотношение между ионами, правильные температура и давление. Образование нейтральных соединений может быть использовано для различных целей, включая применение в качестве катализаторов или сырья для производства других химических соединений.
В целом, избирательное взаимодействие между твердыми кислотными оксидами и основными оксидами активных металлов является сложным и многофакторным процессом, который может приводить к образованию различных продуктов в зависимости от условий реакции и свойств реагирующих веществ. Исследование этого взаимодействия является важной задачей в области химии и может иметь большое практическое значение для разработки новых материалов и химических процессов.
Катализаторы

Катализаторы — это вещества, которые повышают скорость химической реакции, не участвуя при этом в реакции.
В контексте реакций между твердыми кислотными оксидами и основными оксидами активных металлов, катализаторы могут выполнять несколько функций. Они могут служить активным центром, на поверхности которого происходит адсорбция реагентов, образующих активное промежуточное соединение. Кроме того, катализаторы могут способствовать изменению энергетических барьеров, снижая активационную энергию реакции и ускоряя химические процессы.
Примерами катализаторов в реакциях твердых кислотных оксидов с основными оксидами могут служить металлические соединения, такие как платина, родий, никель и др. Они могут использоваться в виде наночастиц, нанокластеров или нанокристаллов, чтобы иметь большую поверхность для взаимодействия с реагентами. Также в качестве катализаторов могут выступать основные оксиды, суперкислоты или феррокислоты.
Использование катализаторов позволяет ускорить химическую реакцию и снизить температуру, при которой происходит реакция. Это важно как с экономической, так и с экологической точки зрения. Катализаторы позволяют сэкономить энергию, использовать меньшее количество реагентов и снизить выделение вредных веществ в атмосферу.
Практическое применение

Реакция твердых кислотных оксидов с основными оксидами активных металлов имеет широкое практическое применение в различных областях, включая химическую промышленность, производство материалов и энергетическую отрасль.
Одно из основных применений этой реакции - получение солей. При взаимодействии кислотных оксидов с основными оксидами образуются соли, которые активно используются в химической промышленности. Эти соли могут быть использованы в качестве катализаторов, растворителей, пигментов и многих других компонентов в различных химических процессах.
В производстве материалов также возможно использование реакции твердых кислотных оксидов с основными оксидами. Например, при взаимодействии кислотных оксидов с оксидами активных металлов можно получить различные композиционные материалы с уникальными свойствами. Эти материалы могут быть использованы в различных отраслях промышленности, таких как строительство, авиация, электроника и другие.
Также стоит отметить, что реакция твердых кислотных оксидов с основными оксидами активных металлов может быть использована в энергетической отрасли. Например, в процессе производства топлива могут быть использованы реакции между кислотными оксидами и оксидами активных металлов для получения необходимых химических веществ. Эти вещества могут быть использованы в процессе сжигания топлива для получения энергии.
Таким образом, реакция твердых кислотных оксидов с основными оксидами активных металлов имеет широкие практические применения в различных областях, включая химическую промышленность, производство материалов и энергетическую отрасль. Эти применения способствуют развитию и оптимизации процессов в данных отраслях, а также созданию новых материалов и технологий.
Вопрос-ответ

Какие реакции между твердыми кислотными оксидами и основными оксидами активных металлов возможны?
Реакция между твердыми кислотными оксидами и основными оксидами активных металлов может протекать по типу образования соли. В результате такой реакции образуются соли, которые состоят из ионов активного металла и ионов кислотного оксида.
Какие кислотные оксиды могут реагировать с основными оксидами активных металлов?
Реагировать с основными оксидами активных металлов могут различные кислотные оксиды, например оксиды серы, азота, фосфора и других элементов. Однако, у каждого кислотного оксида есть свой уровень активности и скорость реакции будет зависеть от данных параметров.
Какое значение имеет реакция между кислотными и основными оксидами для производства солей?
Реакция между кислотными и основными оксидами активных металлов имеет важное значение в производстве солей. Образующиеся при этой реакции соли практически неограниченно используются в различных отраслях промышленности, в химической и фармацевтической промышленности, а также в сельском хозяйстве и пищевой промышленности.
Является ли реакция между кислотными и основными оксидами основой для получения солей в природе?
Реакция между кислотными и основными оксидами активных металлов не является основой для получения солей в природе. В природе соли образуются в результате различных геологических процессов, таких как выветривание минералов или образование осадочных пород. Однако, реакции между кислотными и основными оксидами активных металлов имеют важное промышленное значение для получения солей.
