Ионная связь – это вид химической связи, при котором происходит перенос электронов от одного атома к другому. В результате этого один атом становится положительно заряженным и называется ионом положительного заряда (катионом), а другой – отрицательно заряженным ионом (анионом). Ионная связь образуется между атомами с разными электроотрицательностями, то есть между металлами и неметаллами. Примером ионной связи может служить соединение натрия (Na) и хлора (Cl), образующее ионный кристалл – хлорид натрия (NaCl).
Ковалентная связь – это связь, при которой электроны разделяются между атомами. Они притягивают друг друга силой электростатического притяжения. Образуется ковалентная связь между неметаллами или между атомом водорода и другим атомом. Ковалентная связь может быть одиночной, когда между атомами обменивается только одна пара электронов, или множественной, когда обменивается несколько пар электронов. Ковалентные связи обычно более прочны и нежелательны, чем ионные связи.
Полярная связь – это связь, при которой электроны не равномерно распределены между атомами. В результате образуется так называемый положительный и отрицательный полюса. Это происходит из-за разной электроотрицательности атомов. Полярные связи существуют в молекулах, где углерод, кислород, азот или сера образуют связь с водородом или когда между электроотрицательными элементами формируется ковалентная связь.
Неполярная связь – это связь между атомами, при которой электроны равномерно распределены. В неполярных связях электроотрицательность атомов примерно одинакова, и нет разделения зарядов. Примером неполярной связи может служить связь между атомами углерода и водорода в молекуле метана (CH4).
Важно отметить, что тип связи между атомами зависит от их электроотрицательности и способности принять или отдать электроны. Знание этих типов связей помогает понять основные принципы химической связи и позволяет объяснить свойства и реактивность различных веществ.
Типы связей между атомами
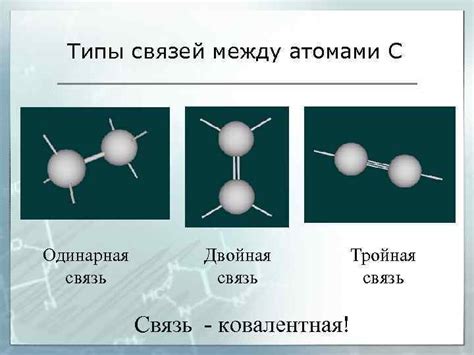
Молекулы и соединения образуются благодаря связям между атомами. Существуют различные типы связей, которые зависят от характера взаимодействия атомов.
Ионная связь - это тип связи, при котором происходит передача или приём электронов от одного атома к другому. В результате образуется положительно ионное и отрицательно ионное вещество, которые притягиваются друг к другу притяжением противоположных зарядов.
Ковалентная связь возникает, когда два атома делят одну или несколько пар электронов. Это наиболее распространенный тип связи, встречающийся в молекулярных соединениях. Ковалентная связь может быть одинарной или множественной в зависимости от количества общих электронных пар.
Полярная связь возникает, когда электроны в молекуле не равномерно распределены и образуют заряженные участки. Это происходит, когда атомы имеют разную электроотрицательность. Полярная связь создает положительные и отрицательные полюса в молекуле, что приводит к образованию диполя.
Неполярная связь возникает, когда электроны в молекуле равномерно распределены и не образуют заряженных участков. Это происходит, когда атомы имеют примерно одинаковую электроотрицательность. Неполярная связь не создает диполя и не обладает полярностью.
Ионная связь: что это такое?

Ионная связь – это тип химической связи между атомами, при котором происходит перенос или передача электронов между атомами, образуя положительно и отрицательно заряженные ионы.
Ионная связь возникает между атомами сильно электроотрицательных и электроположительных элементов. Электролиты, растворяющиеся в воде и ионизирующиеся, образуют ионные связи. Такие соединения обычно обладают высокой температурой плавления и кипения, а также хорошей электропроводностью в расплавленном или растворенном состоянии.
В ионной связи, один атом отдает одно или несколько электронов другому атому, образуя положительный ион. Второй атом принимает эти электроны и образует отрицательный ион. Притяжение противоположно заряженных ионов образует прочную ионную связь.
Ионные связи характеризуются высокой степенью поляризации и сильным кулоновским взаимодействием, что делает эти соединения стабильными и нелетучими. Примерами ионных соединений являются хлорид натрия (NaCl), гидроксид натрия (NaOH) и оксид кальция (CaO).
Ковалентная связь: механизм образования
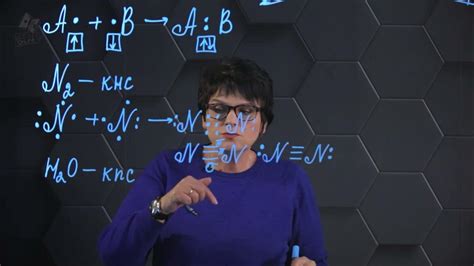
Ковалентная связь - это тип химической связи, который возникает между атомами, когда они обменивают электроны. Этот механизм образования связи основан на идее об общем использовании электронов во внешней оболочке.
В процессе образования ковалентной связи два атома располагаются достаточно близко друг к другу, чтобы электроны их внешних оболочек создавали электронную область некоторого объема. В этой области электроны принадлежат обоим атомам, образуя так называемые "общие электроны".
Ковалентная связь может быть однородной, когда оба атома обменивают равное количество электронов, и неполярной, когда электроны полностью равномерно распределяются между атомами. В то же время, ковалентная связь может быть и разнородной, когда один атом вытесняет электроны у другого атома, формируя полярную ковалентную связь.
Механизм образования ковалентной связи впервые был предложен в 1916 году голландским химиком Хейзенбергом и получил название "общей электронной модели" или "теории обменного электрона". Эта модель является важной основой для объяснения множества химических явлений и позволяет понять, как образуются молекулы и соединения в химических реакциях.
Ковалентная связь: примеры в природе
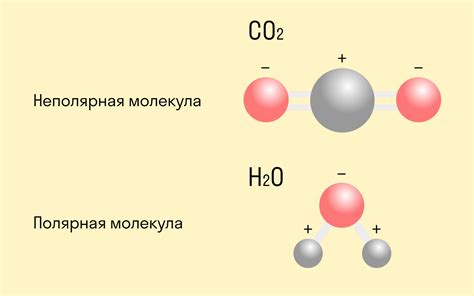
Ковалентная связь - это тип химической связи, при котором атомы связываются путем обмена электронами. Это происходит, когда электроны в валентной оболочке атомов перекрываются и образуют общую электронную пару, удерживаемую обоими атомами. Ковалентная связь встречается во многих веществах в природе.
Один из примеров таких веществ - молекула воды (H2O). В молекуле воды два атома водорода связаны с атомом кислорода через ковалентные связи. Каждый атом водорода делит свои валентные электроны с атомом кислорода, образуя две общие электронные пары и надежно удерживая молекулу воды вместе.
Еще один пример - молекула метана (CH4). В молекуле метана четыре атома водорода связаны с атомом углерода через ковалентные связи. Каждый атом водорода делит свои валентные электроны с атомом углерода, образуя четыре общие электронные пары и обеспечивая стабильность молекулы метана.
Ковалентная связь также встречается в органических веществах, таких как глюкоза и аминокислоты, которые играют ключевую роль в биологических процессах. Они содержат сложные сети атомов, связанных ковалентными связями, которые обеспечивают их функциональность и структурную целостность.
В итоге, ковалентная связь является одним из основных типов связей в химии и играет важную роль в формировании различных веществ в природе, от молекул веществ до органических молекул, необходимых для жизни.
Полярная связь: сущность процесса
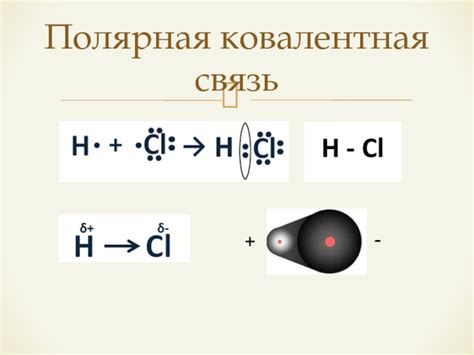
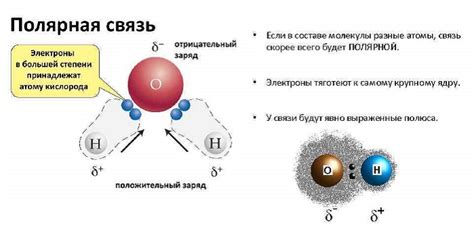
Полярная связь - это тип связи между атомами, в котором электроны не распределяются равномерно и образуется положительный и отрицательный полярные заряды. При этом образуется диполь, состоящий из двух противоположных зарядов, что создает разность электрического потенциала между атомами.
Процесс образования полярной связи начинается с двух атомов, имеющих разные электроотрицательности. Атом с большей электроотрицательностью притягивает электроны к себе сильнее, оставляя у себя отрицательный заряд, а у атома с меньшей электроотрицательностью образуется положительный заряд. Таким образом, образуется полярная связь, где электронная плотность смещается в сторону более электроотрицательного атома.
Для понимания сущности полярной связи необходимо учитывать, что разность электроотрицательностей двух атомов определяет степень полярности связи. Чем больше разность электроотрицательностей, тем сильнее полярная связь. Важно отметить, что полярная связь может существовать как между атомами одного элемента, так и между разными элементами.
Полярные связи играют важную роль в химических реакциях и взаимодействиях между молекулами. Они определяют физические и химические свойства веществ, такие как температура плавления и кипения, растворимость, а также их поведение в электрическом поле. Понимание процесса образования и влияния полярной связи позволяет более глубоко понять принципы взаимодействий в химии и Мы ежедневно сталкиваемся с примерами полярных связей в нашей жизни, начиная от взаимодействий между молекулами вещества, и растворимости веществ, и играет важную роль в различных областях, таких как материаловедение, фармакология и экология.
Полярность в жизни: примеры из химии
Полярность является важным понятием в химии, определяющим взаимодействие молекул и соединений. Полярность связи между атомами в молекуле приводит к появлению разности зарядов и созданию диполя. Это свойство находит свое применение во многих химических и физических процессах.
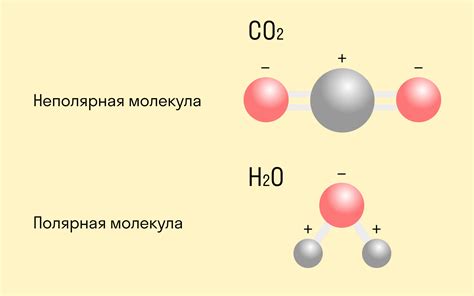
Один из примеров полярности в химии - взаимодействие между атомами водорода и кислорода в молекуле воды. Атомы кислорода сильнее притягивают электроны к себе, что делает воду полярной молекулой. Это важно для понимания свойств воды, таких как ее способность растворять другие вещества и обладать поверхностным натяжением.
Еще одним примером можно привести соединение хлорида натрия (NaCl), более известное как поваренная соль. В этом соле натрий (Na) отдает свой электрон хлору (Cl), что создает ионное взаимодействие. Полярность ионной связи в соли делает ее растворимой в воде и позволяет использовать ее для придания вкуса и улучшения сохранности пищевых продуктов.
Полярность также играет роль в реакциях органической химии. Например, полярная связь в этиловом спирте (CH3CH2OH) позволяет ему растворяться в воде и использоваться в качестве растворителя. Кроме того, полярность ковалентной связи в молекулах органических соединений определяет их реакционную активность и возможность образования сложных структур.
- Полярность - это ключевая характеристика взаимодействия атомов и молекул в химии.
- Примеры полярности включают молекулу воды, ионные соединения и органические соединения.
- Полярность воды имеет важное значение для ее уникальных свойств, таких как растворимость и поверхностное натяжение.
- Ионное взаимодействие между металлом и неметаллом в соли определяет их растворимость и использование в пищевой промышленности.
- Полярность ковалентных связей в органических соединениях влияет на их реакционную активность и возможность образования сложных структур.
Неполярная связь: определение и свойства
Неполярная связь - это тип химической связи между атомами, при которой электроны между ними распределены равномерно и их заряды не смещены в какую-либо сторону. В результате неполярной связи образуется молекула, в которой атомы взаимодействуют друг с другом с равной силой.
Основным свойством неполярной связи является равномерное распределение электронов между атомами. Это происходит, когда между атомами нет значительной разницы в электроотрицательности. При неполярной связи электроны орбитализируют вокруг атомов без создания зарядов, что позволяет им быть стабильными и инертными.
Неполярные связи встречаются в различных соединениях, таких как молекулы углеводородов (например, метан), некоторые галогены и инертные газы (например, аргон). В таких молекулах каждый атом взаимодействует с соседними атомами с равной силой, и электроны равномерно распределены между ними, не образуя зарядов.
Неполярная связь является важным понятием в химии и имеет значительное влияние на физические и химические свойства веществ. Молекулы с неполярными связями обычно имеют низкую температуру кипения и плавления, а также слабую поларизуемость. Это связано с отсутствием зарядов и слабым взаимодействием с другими молекулами или растворителями.
Неполярные соединения в химии: примеры
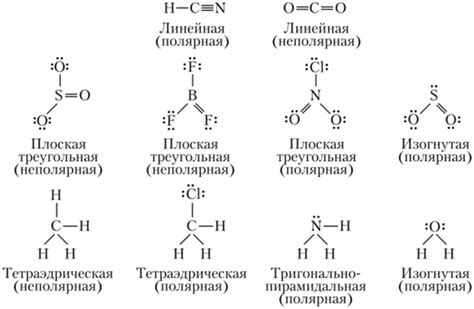
Неполярные соединения в химии — это соединения, в которых электроотрицательности атомов, образующих связь, практически одинаковы или очень близки. В таких молекулах электроны равномерно распределены между атомами, что влияет на их химические свойства. Неполярные соединения образуются при ковалентной связи между атомами.
Примером неполярного соединения является молекула бензола. В ней шесть атомов углерода связаны с атомами водорода, а также образуют кольцевую структуру. В молекуле бензола все связи между атомами углерода и водорода имеют одинаковую силу, что делает ее неполярной.
Другим примером неполярного соединения является молекула метана (CH4). В метане четыре атома водорода равномерно распределены вокруг атома углерода. Связи между атомами водорода и углеродом в метане также обладают одинаковой силой, что делает его молекулу неполярной.
Также можно выделить молекулу ацетона (CH3COCH3) как пример неполярного соединения. В ацетоне два атома углерода связаны с атомами водорода и образуют углеродную цепь. В молекуле ацетона связи между атомами водорода и углеродом одинаково сильны, что делает ее неполярной.
Неполярные соединения обладают рядом химических свойств, таких как низкая поларность и отсутствие дипольного момента. Их важность в химии заключается в возможности использования неполярных растворителей, таких как бензол, эфир или гексан, для растворения неполярных веществ и проведения химических реакций.
Сравнение связей: итоги
Ионная связь - это связь между атомами, которая образуется в результате передачи или приема электронов от одного атома к другому. Частицы, образованные при этом, называются ионами. Ионная связь характеризуется высокой электрической проводимостью и кристаллической структурой. Она образуется между атомами сильно электроотрицательных и электроположительных элементов.
Ковалентная связь - это связь между атомами, в которой электроны общей оболочки делятся между ними. Такая связь образуется между неметаллами и характеризуется низкой электрической проводимостью и низкой температурой плавления. Атомы, образующие ковалентную связь, могут быть одинаковыми или разными.
Полярная связь - это разновидность ковалентной связи, в которой электроны общей оболочки перераспределяются неоднородно, создавая положительные и отрицательные частичные заряды. Полярная связь образуется между атомами с различной электроотрицательностью. Она характеризуется высокой полярностью, что приводит к образованию диполя.
Неполярная связь - это разновидность ковалентной связи, в которой электроны общей оболочки равномерно распределены между атомами, создавая симметричную структуру. Неполярная связь образуется между атомами с одинаковой электроотрицательностью. Она характеризуется низкой полярностью и отсутствием диполя.
Таким образом, ионная связь отличается от ковалентной, полярная связь отличается от неполярной. Каждый тип связи обладает своими уникальными свойствами и характеристиками, что делает их важными и необходимыми для образования различных химических соединений.
Вопрос-ответ

Чем отличается ионная связь от ковалентной?
Ионная связь характеризуется переносом электронов от одного атома к другому, что приводит к образованию ионов с противоположными зарядами. Ковалентная связь же возникает при совместном использовании электронов двумя атомами, что приводит к образованию молекулы.
Что такое полярная связь?
Полярная связь возникает при неравномерном распределении электронной плотности между атомами. В такой связи один атом притягивает электроны сильнее, чем другой, что создает положительный и отрицательный полюсы внутри молекулы.
В чем разница между полярной и неполярной связью?
Основная разница между полярной и неполярной связью заключается в равномерном или неравномерном распределении электронной плотности между атомами. В полярной связи электронная плотность неравномерно распределена, что приводит к созданию диполя, а в неполярной связи электронная плотность равномерно распределена.
Какие связи сильнее: ионные или ковалентные?
Сильнее ионные связи. В ионной связи происходит передача электронов от одного атома к другому, что приводит к образованию ионов с противоположными зарядами. Эта связь обладает очень высокой прочностью. Ковалентные связи же, хотя и обладают определенной прочностью, обычно слабее ионных.
Какие связи образуются между атомами металлов?
Металлы образуют между собой металлические связи. В таких связях электроны образуют общие энергетические уровни множества атомов, что придает металлам их характеристические свойства: проводимость тепла и электричества, металлический блеск и т. д.
