Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, являются химической группой элементов, которые характеризуются активным поведением при взаимодействии с другими веществами. Их реакции обладают определенными особенностями и выделяются высокой реакционной способностью.
Одной из основных характеристик щелочных металлов является их способность образовывать ионы металла с положительным зарядом. Эти ионы становятся основой для формирования различных соединений, например, с кислотами. Реакции с кислотами представляют собой образование солей и выделение водорода. Выделение водорода при взаимодействии щелочных металлов с водой является одной из наиболее известных реакций этой группы элементов.
Кроме того, щелочные металлы проявляют реактивность и при взаимодействии с кислородом и галогенами. В результате таких реакций образуются соответствующие оксиды и галогениды. Например, литий соединяется с кислородом, образуя оксид лития (Li2O), а также с хлором, образуя хлорид лития (LiCl).
Таким образом, химические реакции щелочных металлов отличаются высокой активностью и позволяют получать различные вещества, в том числе соли, оксиды и галогениды. Их химическое поведение широко используется в различных областях, включая фармацевтику, металлургию, электроэнергетику и другие.
Литий в реакциях с кислородом и водой

Литий – это химический элемент из группы щелочных металлов, обладающий высокой активностью. Он легко реагирует с кислородом и водой, и эти реакции имеют свои особенности.
Когда литий вступает в реакцию с кислородом, образуется оксид лития (Li2O). Это белое кристаллическое вещество, которое обладает свойствами щелочноземельных оксидов. Оно растворяется в воде, образуя щелочное растворение. Оксид лития обладает высокой щелочностью и может использоваться в производстве стекла, литий-ионных аккумуляторов и других промышленных продуктах.
Когда литий реагирует с водой, он исходно образует литийгидроксид (LiOH) и выделяется водород. Реакция проходит с выделением тепла и является очень быстрой и взрывоопасной. Литийгидроксид – это сильная щелочь, которая может использоваться в качестве поглотителя углекислого газа, а также в производстве мыла, синтетической резины и других химических соединений.
Учитывая высокую активность лития, его реакции с кислородом и водой должны проводиться с осторожностью в специальном оборудовании и под контролем профессионалов.
Натрий во взаимодействии с водой и хлором

Взаимодействие натрия с водой:
Натрий относится к щелочным металлам и проявляет активность при реакции с водой. При взаимодействии с водой натрий образует щелочной гидроксид и выделяется водород.
Уравнение реакции выглядит следующим образом:
2Na + 2H₂O → 2NaOH + H₂↑
При этой реакции натрий активно взаимодействует с молекулами воды, отбирая у них кислород и выделяя молекулы водорода. Выделяющийся водород образует пузырьки, они и являются видимым проявлением реакции.
Взаимодействие натрия с хлором:
Натрий также проявляет активность при взаимодействии с хлором. Они образуют соль хлорида натрия – основной соли натрия.
Уравнение реакции выглядит следующим образом:
2Na + Cl₂ → 2NaCl
При этой реакции натрий и хлор вступают в реакцию с образованием молекулы хлорида натрия. Эта реакция происходит при нагревании и сопровождается эффектом горения и яркого свечения.
Калий в реакциях с кислородом и хлором

Калий - это щелочной металл, который обладает химической реактивностью. Он представляет собой мягкий, серебристо-белый металл, который взаимодействует с кислородом и хлором, образуя соответствующие соединения.
Взаимодействие калия с кислородом приводит к образованию оксида калия (K2O). Это белое твердое вещество, которое образуется при сжигании калия на воздухе. Оксид калия растворим в воде и обладает щелочными свойствами, образуя гидроксид калия (KOH) в реакции с водой. Гидроксид калия широко используется в промышленности и лабораториях как щелочное вещество.
Калий также реагирует с хлором, образуя хлорид калия (KCl). Хлорид калия представляет собой белый кристаллический порошок, который хорошо растворяется в воде. Он широко используется в пищевой промышленности и медицине.
Реакции калия с кислородом и хлором являются типичными для щелочных металлов. Эти реакции происходят с выделением энергии и образованием стабильных соединений.
Рубидий в контакте с водой и кислородом

Рубидий (Rb) - щелочной металл, который легко взаимодействует с водой и кислородом.
Взаимодействие рубидия с водой происходит с образованием водорода и рубидия гидроксида. При этом наблюдается выделение большого количества тепла. Вода действует на рубидий очень активно, что делает его опасным веществом для работы без необходимой оснастки и защитных средств.
В контакте с кислородом рубидий горит с ярко-красным пламенем, что является одним из характерных свойств щелочных металлов. Это горение происходит благодаря высокой реакционной способности рубидия, который быстро протекает с кислородом и образует оксид рубидия. Образующийся в результате процесса оксид обладает ярко-красным цветом, что объясняет характерное пламя.
Рубидий является одним из наиболее активных элементов, поэтому его взаимодействие с водой и кислородом обладает высокой энергией и интенсивностью реакции. Эти свойства делают рубидий опасным веществом, которое требует особого внимания при обращении и использовании.
Цезий во взаимодействии с кислородом и водой

Цезий (Cs) - щелочной металл, который характеризуется активностью во взаимодействии с кислородом и водой.
Взаимодействие цезия с кислородом происходит воздухе при нормальных условиях температуры и давления. При этом образуется оксид цезия (Cs2O), который является стабильным веществом. Оксид цезия обладает высокой температурой плавления и используется для производства керамических материалов.
Цезий также реагирует с водой, образуя гидроксид цезия (CsOH). Это щелочное вещество, которое растворяется в воде и формирует щелочную среду. Гидроксид цезия используется в различных отраслях промышленности, включая производство стекла и медицинские препараты.
При контакте с водой цезий может проявить пирофорные свойства, то есть воспламеняться самопроизвольно. Поэтому обработка цезия должна проводиться с особой осторожностью и в специальных условиях.
В целом, реакции цезия с кислородом и водой являются типичными проявлениями химической активности щелочных металлов и имеют широкое применение в различных областях техники и науки.
Франций в реакциях с водой и кислородом

Франций - это щелочной металл, обладающий химическим элементом с атомным номером 87. Он является наиболее редким и тяжелым из всех щелочных металлов. В силу своей высокой реактивности, франций проявляет интересные особенности при контакте с водой и кислородом.
При реакции франция с водой происходит весьма сильное взаимодействие. Франций реагирует с водой, образуя гидроксид франция (FrOH) и выделяя водород. Данная реакция является очень экзотической, так как франций является наиболее реактивным из всех щелочных металлов. Кроме того, из-за своей редкости, франций встречается в природе в очень малых количествах, что делает его изучение сложным.
Еще одной интересной особенностью франция является его реакция с кислородом. При взаимодействии франция с кислородом образуется кислородид франция (Fr2O). Реакция происходит с выделением большого количества тепла из-за высокой реактивности франция. Кислородид франция - это крайне нестабильное вещество, которое образуется лишь в лабораторных условиях и не имеет практического значения.
Итак, франций в реакциях с водой и кислородом проявляет свою высокую реактивность. Реакция с водой приводит к образованию гидроксида франция и выделению водорода, а реакция с кислородом приводит к образованию кислородида франция и выделению большого количества тепла. Эти реакции являются не только интересными для изучения, но и служат основой для исследования химических свойств редких и тяжелых щелочных металлов в целом.
Общие химические свойства щелочных металлов
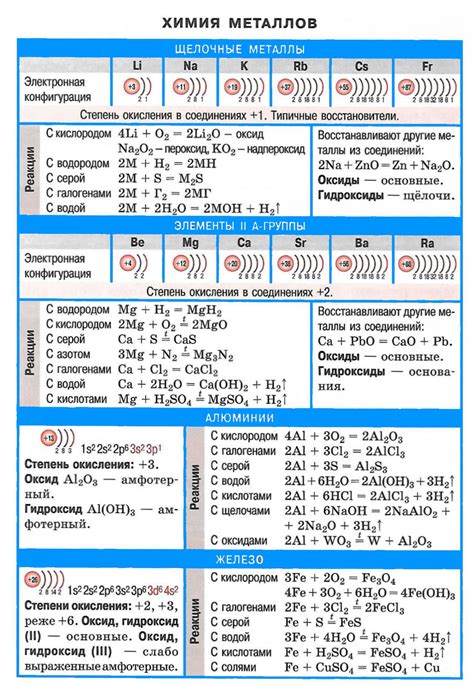
Щелочные металлы являются группой химических элементов, которые входят в первую группу периодической системы. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Они положительно заряжены и обладают высокой реакционной способностью.
Одним из основных свойств щелочных металлов является их реакция с водой. При контакте с водой они образуют щелочи, то есть гидроксиды. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя гидроген:
2Na + 2H2O → 2NaOH + H2
Также щелочные металлы реагируют с кислородом. При этом они образуют оксиды. Например, литий с кислородом образует оксид лития:
4Li + O2 → 2Li2O
Щелочные металлы имеют низкую электроотрицательность, поэтому они легко отдают свои электроны и образуют положительный ион. Они относятся к самым активным химическим элементам.
Щелочные металлы обладают высокой электропроводностью и хорошо растворяются в воде. Они также способны образовывать соли с различными кислотами.
Вопрос-ответ

Какие вещества можно получить в результате реакции щелочных металлов с кислородом?
При реакции щелочных металлов с кислородом образуются оксиды щелочных металлов, такие как оксид натрия (Na2O), оксид калия (K2O) и оксид лития (Li2O).
Как реагируют щелочные металлы с водой?
Щелочные металлы, такие как натрий, калий и литий, реагируют с водой, образуя гидроксиды и высвобождая водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия (NaOH) и выделению водорода (H2).
Какие газы образуются при реакции щелочных металлов с кислотами?
При реакции щелочных металлов с кислотами, такими как соляная кислота (HCl) или серная кислота (H2SO4), образуются соли и высвобождается водородный газ (H2).
Что происходит при реакции щелочных металлов с галогенами?
При реакции щелочных металлов с галогенами, такими как хлор (Cl2), бром (Br2) и йод (I2), образуются соли галогенов и металлические галогены. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl) и белого осадка хлорида натрия (NaCl).
Какие реакции возникают при взаимодействии щелочных металлов с аммиаком?
При взаимодействии щелочных металлов с аммиаком образуются соли, такие как гидроксид натрия, оксид натрия и металлический аммиак. Например, реакция натрия с аммиаком приводит к образованию гидроксида натрия (NaOH) и металлического аммиака (NaNH2).
