Химия - одна из наук, изучающих строение, состояние и свойства вещества. Особое внимание в химии уделяется взаимодействию металлов, так как они имеют широкое применение в различных отраслях промышленности и повседневной жизни.
Металлы обладают высокой термической и электрической проводимостью, прочностью и другими уникальными свойствами, которые делают их неотъемлемой частью современного мира. Однако, при использовании металлов в различных сферах, необходимо учитывать их взаимодействие с другими веществами и средами, чтобы избежать непредвиденных последствий.
Взаимодействие металлов с кислотами, щелочами, воздухом и другими веществами может приводить к различным химическим реакциям, которые влияют на их свойства и долговечность. Поэтому знание основных химических реакций с участием металлов является важным для понимания их поведения и правильного использования.
Пройдите наш тест по химии и проверьте свои знания о взаимодействии металлов! Узнайте, как правильно реагировать в различных ситуациях и как улучшить химические процессы с участием металлов.
Химический состав металлов
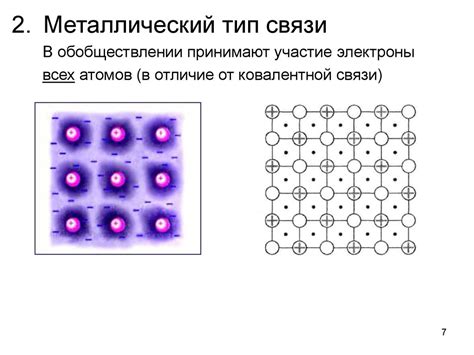
Металлы – это вещества, обладающие определенными химическими и физическими свойствами. Они отличаются от других элементов тем, что их атомы обладают свободными электронами, которые легко могут перемещаться внутри металлической структуры.
Химический состав металлов определяется преимущественно их атомным номером, который указывает на количество протонов в ядре атома. Знание химического состава металлов необходимо для определения их физических и химических свойств, а также для проведения различных экспериментов и исследований.
В таблице Менделеева многие металлы представлены отдельными элементами. Некоторые металлы находятся в одной группе, что указывает на их сходство в химических свойствах. К примеру, металлы из группы железа (Fe, Co, Ni) обладают сходными химическими свойствами и проявляют способность образовывать соединения с различными не-металлами.
Химический состав металлов также обуславливает их реактивность. Некоторые металлы, например, натрий (Na) и калий (K), становятся очень реактивными при контакте с водой, проявляя активное взаимодействие. Другие металлы, такие как золото (Au) и платина (Pt), обладают низкой реактивностью и не проявляют способность образовывать соединения с большинством не-металлов.
Химический состав металлов играет важную роль в различных отраслях промышленности. Зная химические свойства металлов, можно создавать новые сплавы, улучшать технологические процессы и разрабатывать новые материалы с улучшенными свойствами. Например, добавление небольшого количества другого металла в сплав может значительно повысить его прочность и стойкость к коррозии.
Способы защиты металлов от окисления

Окисление является одной из основных причин разрушения металлов и сплавов. Окислительная реакция металлов с кислородом приводит к образованию оксидов, которые обладают прочной защитной пленкой и препятствуют дальнейшему проникновению кислорода.
Существует несколько способов защиты металлов от окисления. Один из них - нанесение защитных покрытий на поверхность металла. Это может быть покрытие из пластика, краски, лака или покрытие металла металлическим оксидом. Такие покрытия создают барьер между металлом и окружающей средой, предотвращая окисление.
Другой способ защиты - использование антиоксидантов. Антиоксиданты - вещества, которые предотвращают окисление металла путем химических реакций с кислородом. Они образуют на поверхности металла защитную пленку, которая препятствует проникновению кислорода.
Также металлы защищают от окисления путем анодной защиты. Это процесс, при котором металл связывается с более активным металлом, который окисляется первым. Активный металл служит анодом и защищает основной металл от окисления.
Для защиты от окисления металлов применяют также антикоррозионные добавки. Эти добавки препятствуют образованию окислов на поверхности металла и могут быть добавлены к антикоррозийным краскам или лакам для улучшения их защитных свойств.
Наконец, использование вакуума или инертной среды (например, азота или гелия) - еще один способ защиты металлов от окисления. Отсутствие кислорода в окружающей среде исключает возможность окисления металла и предотвращает его разрушение.
Электрохимический способ взаимодействия металлов

Взаимодействие металлов может происходить различными способами, одним из них является электрохимический способ. Этот способ основан на различии потенциалов окисления металлов и их способности к донорству или акцепторству электронов.
В электрохимическом способе взаимодействия металлов активное металлическое вещество окисляется, отдавая электроны, которые переходят на молекулу другого, менее активного металла. Таким образом, происходит электронный перенос от активного металла к менее активному.
Для электрохимического взаимодействия металлов используются электрохимические элементы, такие как гальванические элементы и аккумуляторы. Гальванический элемент состоит из анода (активного металла), катода (менее активного металла) и электролита, который обеспечивает проведение электронов и ионов между анодом и катодом.
- Анод – это металл, который подвергается окислению и отдает электроны.
- Катод – это металл, который принимает электроны и подвергается восстановлению.
- Электролит – это раствор или среда, способствующая перемещению ионов и электронов между анодом и катодом.
При использовании электрохимического способа взаимодействия металлов возникает электрический ток, который может быть использован для питания устройств. Например, аккумуляторы на основе электрохимической реакции могут быть использованы для питания электронных устройств, таких как мобильные телефоны и ноутбуки.
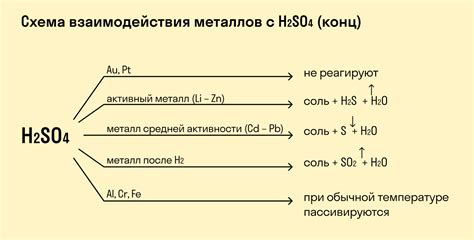
Металлы в реакциях с кислотами

Взаимодействие металлов с кислотами является одним из фундаментальных процессов в химии. Кислоты могут быть как органическими, так и неорганическими соединениями, и они проявляют себя как доноры протонов. Металлы, в свою очередь, выступают в качестве электронных доноров.
В результате реакции металла с кислотой, происходит выброс газа и образование соли. Классическим примером такой реакции является взаимодействие цинка с серной кислотой. При этом образуется соль цинка и выделяется водородный газ.
Список металлов, способных реагировать с кислотами, включает в себя такие элементы, как алюминий, железо, цинк, магний, медь, никель и другие. Однако, каждый металл обладает своей степенью активности и может реагировать только с определенными кислотами.
Важно отметить, что металлы не только реагируют с кислотами, но и могут образовывать с ними соли. Соли, являющиеся результатом реакции металла с кислотой, могут иметь различные свойства и применяются в различных отраслях промышленности и науки.
Металлы в реакциях с основаниями
Реакция металлов с основаниями - одно из важных явлений в химии. Она происходит при взаимодействии металла с щелочью или гидроксидом металла. Эти реакции позволяют установить активность металла и его способность образовывать соли. В основе таких реакций лежит образование гидроксидов металлов, которые могут быть растворимыми или нерастворимыми.
В растворимых гидроксидах металлов реакция протекает по схеме: металл + основание → соль + вода. Например, натрий реагирует с гидроксидом натрия, образуя соль (натриевый гидроксид) и воду. Такие реакции протекают с выделением тепла и обычно сопровождаются выделением пузырей газа.
В нерастворимых гидроксидах металлов реакция протекает по схеме: металл + основание → нерастворимая соль + вода. Например, медь реагирует с гидроксидом меди, образуя нерастворимую соль (медный гидроксид) и воду. Такие реакции ожидаемо протекают без выделения газа и тепла.
Кроме реакций с основаниями, металлы могут образовывать соли и с другими соединениями. Например, реакция металла с кислотой приводит к образованию соли и выделению газа, а реакция металла с неметаллом или его соединением может привести к образованию интерметаллического соединения.
Водородное взаимодействие металлов

Водородное взаимодействие металлов — это химическая реакция, при которой металлы проявляют свою способность образовывать стабильные соединения с водородом. Это взаимодействие может происходить как с добытой из внешней среды молекулярной формой водорода, так и с ионом водорода (протоном), который может присутствовать в водных растворах или в основной реагент, например вода.
Водородное взаимодействие металлов часто проявляется при реакции с кислотами. В этом случае металлы образуют соли, а водород выделяется в виде газа. Некоторые металлы, такие как натрий и калий, реагируют с водой и могут даже воспламеняться при контакте с ней из-за выделения водорода.
Водородное взаимодействие металлов является важным аспектом в области энергоносителей, так как водород широко используется в качестве топлива. Сплавы металлов с высоким содержанием водорода, такие как металлогидриды, используются в технологии водородных батарей и топливных элементов.
Металлы в реакциях с солями

Металлы могут проявлять реакции со солями, что происходит в результате их взаимодействия. В процессе этого взаимодействия соли разлагаются на ионы, а металлы выступают в качестве окислителей.
Реакционная способность металлов в данном случае зависит от их степени активности. Наиболее активные металлы, такие как калий, натрий и литий, обладают высокой реакционной способностью и способны вступать в реакцию даже с наиболее инертными солями. Например, реакция натрия с хлоридом серебра приведет к образованию серебра и хлорида натрия.
Металлы, имеющие среднюю активность, такие как магний, цинк и железо, способны реагировать с солями не всех металлов. Реакции между такими металлами и солями проводятся при образовании газовой фазы или осаждения соединения. В результате таких реакций образуются осадки различных цветов, которые могут служить указателем наличия определенного металла в растворе.
Металлы с низкой активностью, такие как медь, свинец и серебро, не взаимодействуют с большинством солей. Однако они могут реагировать с солями таких металлов, как железо, цинк или марганец. Реакции таких металлов с солями осуществляются при высоких температурах и требуют специальных условий.
Окислительно-восстановительные реакции металлов

Окислительно-восстановительные реакции металлов - это реакции, в которых происходит перенос электронов между атомами. В ходе таких реакций один металл окисляется, теряя электроны, а другой металл восстанавливается, получая электроны.
Важное понятие в окислительно-восстановительных реакциях металлов - потенциал окисления (или редукции). Он определяет способность металла окисляться или восстанавливаться. Чем выше потенциал окисления, тем легче металл окисляется, отдавая электроны. Наоборот, чем ниже потенциал окисления, тем легче металл восстанавливается, принимая электроны.
Известным примером окислительно-восстановительной реакции металлов является реакция между цинком и медью. Здесь цинк окисляется, а медь восстанавливается. Реакцию можно записать следующим образом:
- Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
В ходе этой реакции цинк отдает два электрона и окисляется, образуя ионы цинка. Медь же принимает эти электроны и восстанавливается, образуя медный осадок.
Другим примером окислительно-восстановительной реакции металлов является реакция между алюминием и кислотой. В результате этой реакции алюминий окисляется, образуя ионы алюминия, а кислород восстанавливается:
- 2Al(s) + 6HCl(aq) → 2AlCl3(aq) + 3H2(g)
Исходя из этих примеров, можно заключить, что окислительно-восстановительные реакции металлов широко применяются в промышленности и в жизни. Это важный процесс при производстве металлов, аккумуляторов, электролизе, гальванических элементах и многих других областях.
Вопрос-ответ

Какие металлы взаимодействуют с кислотами?
С кислотами взаимодействуют большинство металлов, но не все. Например, щелочные металлы (натрий, калий), щелочноземельные металлы (магний, кальций) и алюминий реагируют с кислотами, образуя соли и выделяя водород. Однако, металлы из серии платиновых металлов, такие как платина, золото и серебро, не реагируют с кислотами.
Что происходит при взаимодействии металлов с водой?
При взаимодействии металлов с водой образуется гидроксид металла и выделяется водород. Некоторые металлы, такие как натрий и калий, реагируют с водой достаточно быстро и выделяются пузырьки водорода, а другие, как алюминий и железо, реагируют медленно. Однако, не все металлы реагируют с водой. Например, металлы из серии платиновых металлов не реагируют с водой.
Может ли ртуть реагировать с другими металлами?
Ртуть - единственный металл, который при комнатной температуре находится в жидком состоянии. Она не реагирует с большинством металлов, однако может образовывать сплавы, или амальгамы, с некоторыми металлами, такими как натрий, калий и алюминий. Ртуть используется в амальгамационном методе добычи золота и в зубных пломбах.
Как металлы взаимодействуют с кислородом?
Металлы взаимодействуют с кислородом, образуя оксиды металлов. Некоторые металлы, такие как натрий и калий, реагируют с кислородом очень активно и горят на воздухе или при контакте с водой. Другие металлы, такие как железо и алюминий, не реагируют так активно, но все равно могут образовывать оксиды при окислении.
