Щелочные металлы – это элементы, которые находятся в первой группе периодической системы Менделеева. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом характеристических свойств, которые делают их особенно интересными для изучения.
Первое свойство щелочных металлов – низкая плотность. Благодаря этому они обладают большой плавучестью в жидком состоянии и могут даже "плавать" на поверхности воды. Второе свойство – высокая реактивность. Щелочные металлы легко реагируют с кислородом, влагой, хлорами и другими веществами. Их реактивность обусловлена тем, что они стремятся отдать один электрон и образовать ион положительного заряда.
Изучая щелочные металлы, можно узнать многое о химических реакциях и электронной структуре атомов. Тест по щелочным металлам позволит проверить твои знания в этой области. Он включает в себя вопросы о химических свойствах щелочных металлов, их использовании в повседневной жизни, а также о реакциях, в которых они принимают участие. Проверь свои знания и узнай, насколько ты хорошо знаешь эту интересную группу элементов!
Основные свойства щелочных металлов

Щелочные металлы - это группа химических элементов, которые входят в первую группу периодической системы. В этой группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом характеристических свойств, которые делают их уникальными.
Во-первых, щелочные металлы очень реактивны и активно взаимодействуют с кислородом воздуха и водой. При контакте с кислородом они быстро окисляются, образуя оксидную пленку на поверхности, что делает их блестящими. Кроме того, щелочные металлы легко растворяются в воде, образуя щелочные растворы, которые имеют особенность быть щелочными - то есть сильно щелочными.
Во-вторых, щелочные металлы обладают низкой плотностью и низкой температурой плавления, что делает их мягкими и легкообрабатываемыми. Они могут быть нарезаны ножом и формироваться в самые разнообразные формы. Однако, при хранении щелочные металлы защищаются специальными средствами, так как они реагируют с влагой и кислородом из воздуха.
В-третьих, щелочные металлы обладают способностью образовывать ионные соединения, которые обладают множеством полезных свойств. Их соединения широко используются в различных отраслях промышленности, например, в производстве стекла, щелочей и бытовой химии.
Реакции щелочных металлов с водой и кислородом

Щелочные металлы – это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой реактивностью и активностью, особенно при контакте с водой и кислородом.
Реакция щелочных металлов с водой является очень интенсивной и сопровождается выделением водорода. При взаимодействии с водой щелочные металлы образуют гидроксиды и выделяются газы. Например, литий реагирует с водой, образуя литиевую соль растворенную в воде и выделяя водородный газ.
Реакция щелочных металлов с кислородом также происходит очень активно. При этом металлы горят, образуя оксиды. Например, натрий горит в воздухе при образовании оксида натрия. Это явление называется "горением металла на воздухе".
Реакции щелочных металлов с водой и кислородом имеют большое промышленное значение. Например, натрий используется в производстве щелочей и стекла, а литий - в производстве аккумуляторов и сплавов. А также щелочные металлы используются в химии и научных исследованиях.
Химические свойства щелочных металлов

1. Активность
Щелочные металлы – это самые активные металлы в периодической системе. Они имеют наибольшую энергию орибталей валентной оболочки, что обуславливает высокую реакционную способность. Они реагируют с большинством веществ, в том числе с водой и кислородом.
2. Реакция с водой
Щелочные металлы реагируют с водой, образуя гидроксиды и выделяющийся водород. При этом выделяется большое количество тепла. Реакция протекает очень быстро и может сопровождаться образованием пламени.
3. Реакция с кислородом
Щелочные металлы активно взаимодействуют с кислородом, образуя оксиды. Реакция с кислородом происходит с выделением значительного количества тепла и образованием яркого света.
4. Реакция с кислотами
Щелочные металлы реагируют с кислотами, образуя соль и выделяющийся водород. Реакция с кислотами происходит с выделением тепла.
5. Способность образовывать соединения
Щелочные металлы образуют ряд соединений с различными элементами и группами элементов. Например, они могут образовывать соли, оксиды, гидроксиды и другие соединения.
6. Коррозионная устойчивость
Щелочные металлы имеют низкую коррозионную устойчивость и быстро окисляются при взаимодействии с кислородом. Для их сохранения используют специальные методы упаковки и хранения.
Таким образом, щелочные металлы обладают высокой активностью и реакционной способностью, что определяет их химические свойства.
Важные соединения щелочных металлов

Гидроксиды щелочных металлов являются одними из наиболее важных соединений. Они обладают высокой щелочностью и широко применяются в промышленности и в быту. Гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), используются в процессах очистки и обеззараживания воды, в производстве мыла и моющих средств, а также в химической промышленности для синтеза различных соединений.
Азиды щелочных металлов являются еще одним важным классом соединений. Они обладают высокой стабильностью и взрывоопасностью. Азид натрия (NaN3) широко применяется в авиационной и военной промышленности, в качестве инициатора взрывов и пиротехники. Азид натрия также используется для изготовления подушек безопасности в автомобилях.
Пероксиды щелочных металлов также имеют большое значение. Они обладают окислительными свойствами и используются в качестве отбеливателей, агентов дезинфекции и средств для удаления запахов. Пероксид натрия (Na2O2) применяется в текстильной промышленности для отбеливания тканей, а пероксид калия (K2O2) используется в качестве отбеливателя в производстве бумаги.
Соль щелочных металлов также являются важными соединениями. Соль натрия (NaCl) и соль калия (KCl) применяются в пищевой промышленности для придания вкуса и улучшения консистенции продуктов. Они также используются в медицине и фармацевтике как основные компоненты растворов для внутривенного вливания и приготовления лекарственных препаратов.
Применение щелочных металлов в быту и промышленности
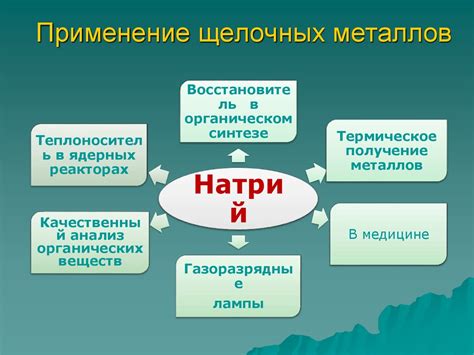
Бытовое применение:
Щелочные металлы, такие как натрий и калий, широко используются в быту. Натрий встречается в пищевой соли, которую мы добавляем в пищу для придания ей вкуса. Калий является важным элементом питания, и его соединения используются в производстве удобрений для растений.
Натрий также находит применение в производстве мыла и моющих средств, благодаря своим моющим свойствам. Он также используется в батарейках и аккумуляторах, где является основным элементом электролитов. Калий используется в производстве стекла и мыла, а также в лампах накаливания.
Промышленное применение:
Щелочные металлы имеют широкое промышленное применение. Натрий и калий используются в металлургии для очистки и обработки металлов. Они также используются в процессе производства мыла, стекла и удобрений.
Натрий находит применение в производстве пластика, красителей, электроники и фармацевтической промышленности. Он также используется в производстве чистящих средств и дезинфицирующих средств, благодаря своим дезинфекционным свойствам.
Калий используется в производстве удобрений, стекла, мыла и красок. Он также применяется в производстве лекарственных препаратов, в качестве катализатора в химической промышленности и в сельском хозяйстве.
Вопрос-ответ

Зачем нужен тест по щелочным металлам?
Тест по щелочным металлам в 9 классе является частью программы по химии, и его цель заключается в проверке знаний учеников о данной группе элементов и их свойствах. Тест помогает учителю оценить уровень усвоения материала, а ученикам - повторить пройденный материал и подготовиться к контрольной работе или экзамену.
Какие темы охватывает тест по щелочным металлам в 9 классе?
Тест по щелочным металлам в 9 классе включает в себя вопросы о химических свойствах щелочных металлов, их реакциях с кислотами и водой, способности к окислению, восстановлению и образованию ионов. Также тест может включать задания на расчеты и аналитические задачи.
