Коррозия металла является довольно распространенным процессом, который приводит к разрушению и деградации материалов. Этот процесс возникает из-за воздействия окружающей среды на поверхность металлической конструкции или изделия, что приводит к образованию окислов и других соединений.
Причины коррозии металла могут быть различными. Одной из основных причин является наличие влаги или влажной среды, в которой металл находится. Вода является электролитом, который способствует образованию электрохимических реакций на поверхности металла. При наличии кислорода воздуха происходит окисление металла, что ведет к его коррозии.
Другой важной причиной коррозии металла являются химические воздействия. Некоторые вещества, такие как кислоты или щелочи, могут иметь агрессивное воздействие на металл, вызывая его разрушение и коррозию. Также коррозию металла может вызывать контакт с другими металлами или сплавами, которые могут образовывать гальваническую пару, сопровождающуюся электрохимическими реакциями.
Механизмы коррозии металла могут быть разнообразными и зависят от конкретной ситуации. Это может быть электрохимическое растворение металла, образование окисных оболочек на поверхности, механическое разрушение или даже биологическое воздействие. В основе каждого механизма лежит изменение состояния материала в результате его реакции с окружающей средой.
Термодинамическая возможность коррозии металла связана с разностью потенциалов, которая возникает между поверхностью металла и окружающей средой. Если разность потенциалов достаточно велика, то происходит перенос электронов между металлом и окружающей средой, что приводит к коррозии металла. При анализе термодинамической возможности коррозии учитываются различные факторы, такие как температура, влажность, pH окружающей среды и содержание токсических веществ.
Влияние термодинамики на коррозию металла
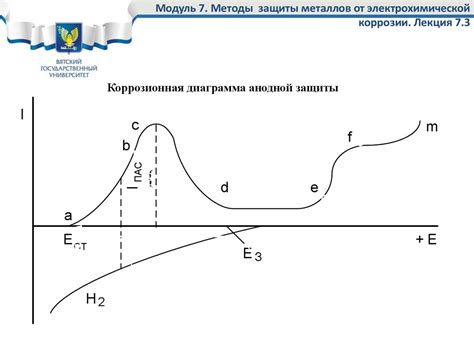
Термодинамика играет важную роль в процессе коррозии металлов. Коррозия - это химическая реакция, при которой металл взаимодействует с окружающей средой и разрушается. Термодинамические факторы определяют возможность возникновения и скорость развития коррозии.
Прежде всего, реакция коррозии должна быть термодинамически возможной. Для этого необходимо, чтобы свободная энергия реакции была отрицательной. В противном случае, реакция не будет происходить самопроизвольно. Таким образом, определение электрохимического потенциала металла относительно потенциала раствора или других реагентов позволяет оценить его термодинамическую стабильность.
Термодинамические факторы также влияют на скорость коррозии металлов. Одним из основных факторов является термодинамическая активация реакции. Это связано с необходимостью преодоления энергетического барьера для инициирования реакции. Чем ниже активационная энергия, тем выше скорость коррозии.
Вода также играет важную роль в термодинамике коррозии металла. Ее наличие может способствовать возникновению реакции коррозии, так как вода является электролитом и обеспечивает проводимость электрического тока для электрохимической реакции. Кроме того, вода может ускорять реакцию специфическими механизмами, такими как образование кислотных растворов, повышение концентрации коррозионных агентов и наличие микробиологической активности.
Таким образом, термодинамика играет важную роль в процессах коррозии металлов. Она определяет возможность и скорость развития коррозии, а также такие факторы, как электрохимический потенциал металла и наличие влаги в окружающей среде. Понимание этих термодинамических процессов является важной задачей при изучении и предотвращении коррозии металлических материалов.
Термодинамические условия коррозии
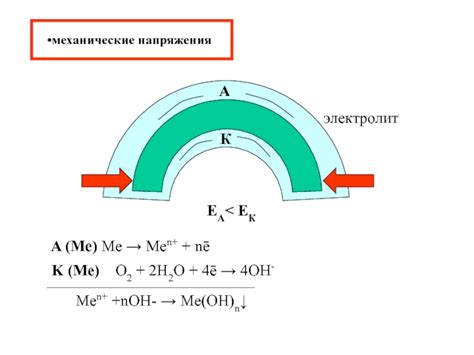
Коррозия металла является сложным физико-химическим процессом, который происходит при взаимодействии металла с окружающей средой. Термодинамические условия играют ключевую роль в возможности и скорости коррозии металла.
Одним из главных факторов, влияющих на термодинамическую возможность коррозии, является потенциал электродного ответа. Взаимодействие металла с окружающей средой происходит за счет разности потенциалов между ним и средой. Если потенциал металла ниже потенциала окружающей среды, то происходит анодное растворение металла, что и называется коррозией.
Также, важным параметром является рН окружающей среды. Если окружающая среда имеет низкий рН, то это способствует активации процессов коррозии, так как низкое значение рН создает условия для образования кислотных растворов, которые способны растворять металл.
Окислительно-восстановительный потенциал среды также влияет на возможность коррозии. Если окружающая среда содержит активные окислители, то они могут участвовать в реакциях с металлом и вызывать его коррозию. Обратно, наличие сильных восстановителей может предотвратить коррозию металла.
Все эти термодинамические условия взаимодействуют между собой и определяют термодинамическую возможность коррозии металлов в разных средах. Поэтому, для предотвращения коррозии необходимо учитывать не только физико-химические свойства окружающей среды, но и управлять термодинамическими параметрами, чтобы создать условия, при которых коррозия будет минимальной.
Окислительно-восстановительные реакции
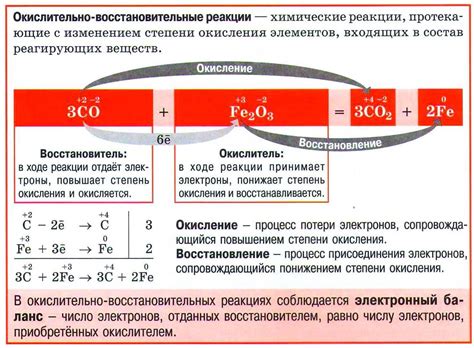
Окислительно-восстановительные реакции являются основным механизмом коррозии металла. Эти реакции происходят между металлом, окружающей средой и электролитом. В результате процесса окисления металла, восстановления других веществ или обоих происходит разрушение металлической структуры и образование коррозионных продуктов.
В окислительно-восстановительных реакциях могут участвовать различные вещества, например, кислород, вода, соли и органические соединения. Наиболее распространенной окислительно-восстановительной реакцией является реакция кислорода из воздуха с металлом, которая приводит к образованию оксидов металла.
В процессе окисления металла происходит передача электронов, что приводит к образованию положительно и отрицательно заряженных ионов. Положительно заряженные ионы перемещаются в электролит, а отрицательно заряженные ионы перемещаются на металлическую поверхность. Это приводит к образованию слоя коррозионных продуктов на поверхности металла.
Один из способов предотвратить окислительно-восстановительные реакции и, следовательно, коррозию металла, - это использование антикоррозионных покрытий. Эти покрытия предотвращают проникновение окружающей среды на поверхность металла и создают защитный барьер. Кроме того, регулярное нанесение защитных покрытий помогает устранить имеющийся слой коррозии и предотвращает дальнейшее развитие процесса.
Электрохимический механизм коррозии
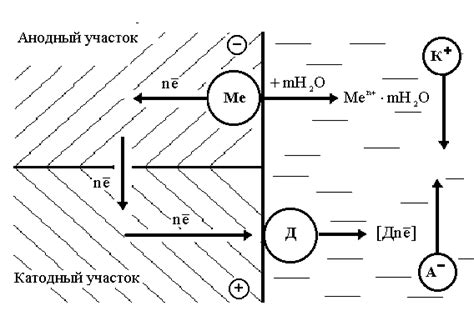
Электрохимический механизм коррозии является одним из наиболее распространенных и важных механизмов разрушения металлических материалов. Он основан на процессах окисления и восстановления, которые происходят на поверхности металла в присутствии электролита.
При наличии влаги или другого электролита на поверхности металла могут образовываться аноды и катоды, которые связаны между собой электролитом. В результате этого процесса происходит движение электронов от анода к катоду, что приводит к растворению атомов металла в электролите.
Коррозию металла можно сравнить с гальваническим элементом, где металл является анодом, а катодом служит другой металл или даже вода. При этом металл анода (который корродирует) выделяет электроны, которые движутся через электролит к катоду и там происходит реакция редокс, при которой происходит осаждение металла или образование неактивной оксидной пленки.
Важным фактором, влияющим на электрохимический механизм коррозии, является наличие концентрационной разницы между анодом и катодом. Если существует большая разница в концентрации электролита или кислотности, то скорость коррозии металла увеличивается.
Электрохимический механизм коррозии широко распространен и имеет многочисленные применения в промышленности и повседневной жизни. Понимание этого механизма позволяет разрабатывать методы предотвращения и защиты от коррозии, которые могут значительно продлить срок службы металлических конструкций и изделий.
Электродный контакт металла с окружающей средой

Электродный контакт металла с окружающей средой является одним из основных факторов, способствующих возникновению и развитию коррозии металла. При контакте с различными средами, металл подвергается электрохимическим процессам, которые могут привести к его разрушению.
Взаимодействие металла с окружающей средой осуществляется посредством электрохимических реакций, в которых металл действует как анод или катод. Анодные и катодные реакции сопровождаются выделением электронов и ионов, что приводит к оседанию на поверхности металла различных продуктов окисления и солей.
Скорость электрохимических реакций в электродном контакте зависит от различных факторов, таких как температура, pH-уровень среды, наличие корродирующих веществ и т.д. Например, при повышенной температуре скорость коррозии может увеличиваться в несколько раз.
Существует несколько механизмов электродного контакта, включая гальваническую пару, электролитическую коррозию и коррозию под покрытием. В гальванической паре металлы разной электрохимической активности вступают в контакт друг с другом, что приводит к возникновению потенциальной разницы и электродной реакции. В случае электролитической коррозии металл находится в контакте с электролитом, который обеспечивает протекание электролитической реакции. Коррозия под покрытием возникает при наличии покрытия на поверхности металла, которое может быть повреждено или иметь дефекты, позволяющие окружающей среде проникнуть и оказывать коррозионное действие.
В целом, электродный контакт металла с окружающей средой является сложным и многогранным процессом, влияющим на развитие коррозии металла. Понимание причин и механизмов данного контакта позволяет разработать эффективные меры по защите металла от коррозии и увеличить его срок службы.
Анодные и катодные реакции

Коррозия металла – это процесс, при котором металл под действием окружающей среды покрывается нежелательным слоем окислов и солей. Одной из основных причин коррозии является разность потенциалов между различными участками поверхности металла, что приводит к возникновению анодных и катодных реакций.
Анодная реакция происходит на поверхности металла, где происходит активное окисление. Это происходит за счет отдачи электронов атомами металла. Например, при коррозии железа возникает анодная реакция, при которой атомы железа переходят в ионы железа Fe3+, отдавая свои электроны внешней среде.
Катодная реакция, напротив, происходит на участке поверхности, где происходит редукция, то есть восстановление. В этом процессе электроны, поступающие извне, приводят к образованию ионов с меньшей степенью окисления. Например, при коррозии железа катодная реакция будет связана с присутствием влаги или кислорода, которые восстанавливают ионы железа, переводя их обратно в атомарное состояние.
Анодные и катодные реакции образуют гальваническую пару, в которой происходит передача электронов через внешнюю цепь. В результате анодные участки металла окисляются, а катодные участки восстанавливаются. Этот режим работы приводит к переносу материала с анода на катод и, в конечном итоге, к разрушению металла вследствие коррозии.
Частота коррозии и скорость разрушения
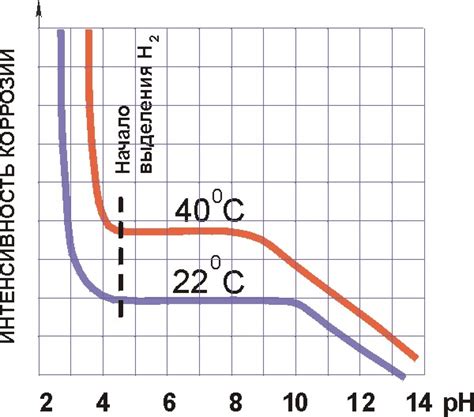
Коррозия металла – это процесс, который может привести к его разрушению и потере функциональности. Частота коррозии и скорость разрушения зависят от нескольких факторов.
Важным фактором является окружающая среда, в которой находится металл. Наличие влаги, кислотных или щелочных растворов, агрессивных газов или солей может значительно ускорить процесс коррозии. Также влияют температура и давление среды.
Вид и состояние металла также влияют на скорость разрушения. К примеру, дефекты структуры металла, такие как трещины или поры, могут стать местом начала коррозии и привести к его быстрому разрушению. Кроме того, химические свойства металла, его чистота и примеси могут существенно повлиять на процесс коррозии.
Особое внимание следует уделить электрохимическим свойствам металла. Электрохимическая коррозия происходит в результате разности потенциалов на поверхности металла в разных местах. Включение металла в электролитическую среду может способствовать этому процессу.
В общем случае, увеличение частоты коррозии и скорости разрушения происходит при сочетании нескольких факторов, включая окружающую среду, состояние металла и его электрохимические свойства. Поэтому для защиты от коррозии и предотвращения разрушения металла необходимо учитывать все эти факторы и принимать соответствующие меры.
Внешние факторы влияющие на коррозию
Коррозия металлов является химическим процессом, который вызывается воздействием различных внешних факторов.
Один из основных факторов, влияющих на коррозию, - это окружающая среда. Влажная среда, такая как воздух или вода, является основной причиной коррозии многих металлов. Влага содержит растворенные газы и соли, которые могут реагировать с металлом и вызывать образование коррозионных продуктов.
Температура также имеет значительное влияние на коррозию металлов. Высокая температура может ускорить химические реакции, происходящие на поверхности металла, и увеличить скорость коррозии. Например, при повышенной температуре окислительные реакции часто протекают быстрее, что может привести к более интенсивной коррозии.
Помимо окружающей среды и температуры, влияние на коррозию металлов оказывает и электрохимический потенциал. Если на поверхности металла присутствуют разные металлы или различные области с разными состояниями окисления, между ними может возникать разность потенциалов, что может вызывать электрохимические реакции и, как следствие, коррозию.
Также стоит учитывать механическое действие, которое может ускорить процесс коррозии. Например, механическое трение или напряжения могут испортить защитные покрытия металла и создать условия для проникновения вредных веществ в металлическую структуру, что приведет к более интенсивной коррозии.
Киноформирующая способность среды
Киноформирующая способность среды является важным фактором в возникновении и прогрессировании коррозии металла. Она определяет, насколько среда способна создать особые условия, при которых металл может быть подвержен коррозии.
Среда, имеющая высокую киноформирующую способность, способна создать внешнюю поверхность металла, которая является неоднородной и неравномерно оксидированной. Это приводит к образованию покрытия на поверхности металла, которое может быть менее устойчивым к коррозии.
Также киноформирующая способность среды может быть связана с ее химическим составом и наличием вредных веществ. Некоторые химические элементы и соединения, такие как кислород, хлор, сероводород и другие, способны усиливать процессы коррозии и делать среду более агрессивной к металлу.
Киноформирующая способность среды может быть оценена и классифицирована с помощью различных методов, таких как определение рН, концентрация вредных веществ, растворимость кислорода и других параметров. Эти данные позволяют инженерам и научным исследователям определить, насколько среда может быть опасной для металлических конструкций и разработать соответствующие защитные меры.
В целом, понимание и изучение киноформирующей способности среды является важным аспектом в борьбе с коррозией металла. Инженерные решения, такие как использование покрытий и защитных слоев, могут быть разработаны на основе данных о киноформирующей способности среды, чтобы предотвратить возникновение и прогрессирование коррозии.
Вопрос-ответ

Почему металл коррозирует?
Коррозия металла происходит по причине его взаимодействия с окружающей средой, основными факторами которой являются кислород, вода и агрессивные химические вещества. В результате этого взаимодействия на поверхности металла образуются оксидные и другие соединения, которые приводят к разрушению и ухудшению его качества.
Какое влияние оказывает температура на коррозию металла?
Температура является одним из факторов, влияющих на скорость коррозии металла. При повышении температуры обычно увеличивается скорость реакций, в том числе и реакций коррозии. Это связано с увеличением активности атомов и молекул, а также с изменением электрохимической активности поверхности металла.
Какие основные механизмы коррозии металла существуют?
Существует несколько основных механизмов коррозии металла, таких как электрохимическая коррозия, химическая коррозия, износовая коррозия и другие. Каждый из этих механизмов имеет свои особенности и причины возникновения, но общая суть всех данных процессов заключается в взаимодействии металла с окружающей средой.
Можно ли предотвратить коррозию металла?
Коррозию металла невозможно полностью предотвратить, так как она является естественным процессом. Однако можно применить различные методы защиты металла от коррозии, такие как использование защитных покрытий, антикоррозионных покрытий или специальных сплавов, а также контроль параметров окружающей среды, таких как влажность, температура и содержание агрессивных сред. Это позволит уменьшить скорость коррозии и продлить срок службы металла.
Какие металлы наиболее подвержены коррозии?
Наиболее подвержены коррозии металлы, которые обладают высокой активностью и электрохимической реакционной способностью. К ним относятся, например, железо, алюминий, медь, цинк. Однако, некоторые металлы, такие как нержавеющая сталь или алюминий с окислением, способны формировать защитные покрытия, которые могут уменьшить скорость коррозии.
