Оксид металла является одним из основных продуктов при термическом разложении различных веществ. Этот процесс, известный также как оксидация, происходит при нагреве вещества до определенной температуры, что приводит к образованию оксида и выделению газовых продуктов.
Термическое разложение вещества происходит в результате взаимодействия его молекул с высокой энергией теплового движения. При достижении определенной температуры происходит разрыв химических связей внутри молекулы, что приводит к образованию новых веществ. Оксид металла образуется, когда металл соединяется с кислородом при высоких температурах.
Образование оксида металла при термическом разложении вещества может иметь различные последствия и применения. Некоторые оксиды металла имеют важное значение в промышленности, так как они обладают особыми свойствами, которые делают их полезными для различных процессов и производств. Например, оксид железа применяется в производстве стали, а оксид алюминия используется в производстве керамики и алюминиевых сплавов.
Образование оксида металла при термическом разложении

Термическое разложение вещества является одним из способов получения оксида металла. При этом процессе происходит разложение исходного вещества под воздействием высокой температуры, что приводит к образованию оксида металла.
Оксид металла — это бинарное соединение, состоящее из металла и кислорода. Он обладает химической формулой MO, где M обозначает металл. Термическое разложение вещества позволяет превратить его в оксид металла путем отделения кислорода.
Для термического разложения вещества необходимо создать условия, при которых произойдет разрушение связей в молекуле и выделение кислорода. Это может быть достигнуто путем нагрева вещества до определенной температуры и проведения процесса в среде, которая будет ускорять реакцию.
Процесс образования оксида металла при термическом разложении может протекать по-разному в зависимости от свойств исходного вещества. Некоторые вещества разлагаются при нагревании до определенной температуры и превращаются в оксид металла. Другие вещества могут быть разложены только в присутствии катализаторов или в определенных условиях окружающей среды.
Термическое разложение и образование оксида металла являются важными процессами в химической промышленности и научных исследованиях. Они позволяют получать оксиды металлов, которые могут быть использованы в различных областях, таких как производство металлургических материалов, катализ и электрохимия.
Процесс термического разложения вещества
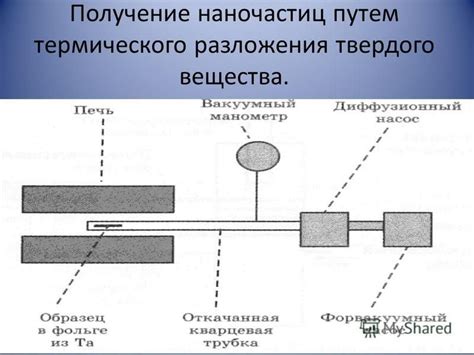
Термическое разложение вещества представляет собой процесс, в результате которого происходит распад молекул под воздействием высокой температуры. Этот процесс обязательно сопровождается отделением газов и образованием оксидов различных элементов.
При термическом разложении вещества происходит изменение его физических и химических свойств. Во время нагревания молекулы вещества начинают вибрировать с большой скоростью, что приводит к разрыву химических связей и образованию новых соединений.
Процесс разложения вещества может быть экзотермическим или эндотермическим, в зависимости от того, выделяется или поглощается теплота. При экзотермическом разложении, энергия выделяется в виде теплоты, что приводит к повышению температуры окружающей среды. В случае эндотермического разложения, теплота поглощается из окружающей среды, что приводит к охлаждению.
Оксиды, образующиеся в результате термического разложения вещества, имеют важное значение в химической промышленности и науке. С помощью оксидов металлов можно получить различные материалы, например, керамику, стекло, металлические сплавы и другие. Кроме того, оксиды металлов используются в качестве катализаторов, в процессах окисления и восстановления, а также в электролитах для аккумуляторов и топливных элементов.
Химическая реакция образования оксида

Химическая реакция образования оксида металла при термическом разложении вещества является одним из основных процессов в химии. Данный процесс происходит при нагревании металла или его соединения в присутствии кислорода.
В результате термического разложения металла или его соединения, происходит окисление. Кислород из воздуха вступает в реакцию с металлом, образуя оксид металла. Оксид металла обладает отличными от металла свойствами и имеет определенную структуру.
Химическая реакция образования оксида может быть выражена следующим уравнением:
Металл + Кислород → Оксид металла
В данной реакции металл является веществом, которое подвергается окислению, а кислород - окислителем. В зависимости от металла и условий реакции, образование оксида может сопровождаться выделением энергии в виде тепла или света.
Оксиды металлов являются важными веществами, применяемыми в различных областях науки и промышленности. Они обладают рядом полезных свойств и находят применение в производстве керамики, стекла, металлургии и других отраслях.
Свойства образовавшегося оксида металла

Оксид металла, образующийся в результате термического разложения вещества, обладает рядом характерных свойств.
Во-первых, оксид металла обычно обладает высокой термической стабильностью. Это значит, что он способен сохранять свою структуру и химические свойства при повышенных температурах. Благодаря этому, оксид металла может использоваться в различных технологических процессах, требующих высоких температур.
Во-вторых, оксид металла обычно обладает высокой химической стойкостью. Это означает, что он не растворяется в большинстве растворителей, не подвергается коррозии и не реагирует с большинством химических веществ. Благодаря этому, оксид металла может использоваться в различных областях, где требуется стойкий материал.
В-третьих, оксид металла обычно обладает высокой электропроводностью. Это значит, что он способен проводить электрический ток. Это свойство делает оксид металла полезным материалом в электронике и электротехнике, где он может использоваться в качестве проводника.
В-четвертых, оксид металла обычно обладает высокими каталитическими свойствами. Это означает, что он способен ускорять химические реакции без изменения своей структуры. Благодаря этому, оксид металла может использоваться в качестве катализатора в различных процессах, включая промышленные производства и экологические технологии.
Физические свойства оксида

1. Цвет: Оксид металла имеет разнообразные цвета, в зависимости от его состава и структуры. Например, вода является оксидом водорода, и имеет бесцветную или слегка голубоватую окраску. Другие оксиды, такие как оксид железа, имеют красный или желтый оттенок, в то время как оксид титана имеет белый цвет.
2. Температура плавления и кипения: Температура плавления и кипения оксида металла зависит от его состава и свойств. Некоторые оксиды имеют очень высокую температуру плавления и кипения, например, оксид алюминия плавится только при очень высокой температуре около 2050 градусов Цельсия, в то время как оксид цинка плавится при более низкой температуре около 1975 градусов Цельсия.
3. Плотность: Плотность оксида металла также зависит от его состава и структуры. Обычно оксиды металлов имеют более высокую плотность по сравнению с соответствующими металлами. Например, плотность оксида алюминия составляет около 3,97 г/см³, в то время как плотность алюминия составляет около 2,7 г/см³.
4. Твердость: Оксид металла обладает разной степенью твердости, в зависимости от его состава. Некоторые оксиды могут быть очень твердыми и хрупкими, как, например, оксид алюминия, который является одним из самых твердых оксидов. Другие оксиды, например, оксид меди, могут быть достаточно мягкими и легко обрабатываемыми.
5. Растворимость: Оксиды металлов обычно не растворяются в воде и растворах кислот и щелочей. Однако некоторые оксиды, такие как оксид натрия и оксид калия, являются исключением и легко растворяются в воде, образуя щелочные растворы. Это свойство делает оксиды натрия и калия важными в промышленности и быту.
6. Проводимость: Некоторые оксиды, такие как оксиды металлов переходных групп, обладают полупроводниковыми свойствами и могут проводить электрический ток. Это свойство делает их важными материалами для производства электронных компонентов, таких как транзисторы и диоды.
Таким образом, физические свойства оксида металла определяют его цвет, температуру плавления и кипения, плотность, твердость, растворимость и проводимость. Эти свойства могут быть использованы для идентификации и определения химического состава оксида, а также для выбора подходящего способа его использования в разных областях науки и промышленности.
Химические свойства оксида

Оксид, как и любое химическое соединение, обладает определенными химическими свойствами. Важнейшими свойствами оксида являются его реакционная способность и способность образовывать соли.
Оксиды подвергаются химической реакции с различными веществами и могут проявлять свойства кислот, оснований или амфотерных соединений в зависимости от их состава и структуры.
Кислотные оксиды реагируют с водой, образуя кислоты. Например, углекислый газ (CO2) соединяется с водой, образуя угольную кислоту:
CO2 + H2O → H2CO3
Основные оксиды реагируют с водой, образуя основания. Например, оксид кальция (CaO) соединяется с водой, образуя гидроксид кальция:
CaO + H2O → Ca(OH)2
Амфотерные оксиды могут реагировать как с кислотами, так и с основаниями. Например, оксид алюминия (Al2O3) реагирует с кислотой серной и образует соль:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Также оксиды металлов могут реагировать с кислородом, образуя пероксиды или супероксиды. Например, оксид натрия (Na2O) реагирует с кислородом, образуя пероксид натрия:
2Na2O + O2 → 2Na2O2
Химические свойства оксида зависят от его состава и структуры, а также внешних условий, таких как температура и давление. Изучение свойств оксидов позволяет более полно понять их роль и применение в химических процессах и технологиях.
Применение оксида металла в различных отраслях

Оксиды металлов являются одними из наиболее распространенных соединений в химии. Их широкое применение связано с их свойствами, такими как высокая степень устойчивости, проводимость и магнитные свойства. Оксиды металлов используются в различных отраслях - от электроники до медицины.
В электронной промышленности оксиды металлов применяются для создания полупроводниковых материалов и солнечных элементов. Например, оксид никеля используется в процессе производства литий-ионных аккумуляторов благодаря своей высокой электропроводности. А оксид кремния служит основным материалом для производства солнечных панелей.
Оксиды металлов также широко используются в катализаторах, которые играют важную роль в процессах промышленного синтеза. Например, оксид титана и оксид циркония применяются в катализаторах для производства полимеров, позволяя значительно увеличить скорость реакции и повысить качество продукта.
Оксиды металлов также находят свое применение в медицине. Оксид цинка, который обладает антисептическим и противовоспалительным действием, используется в лечении различных кожных заболеваний, таких как ожоги и сыпь. А оксид железа применяется в производстве препаратов для лечения железодефицитной анемии.
Таким образом, оксиды металлов являются важными соединениями, которые находят применение в различных отраслях, от электроники до медицины. Их уникальные свойства делают их востребованными материалами для создания новых технологий и лекарственных препаратов.
Вопрос-ответ

Как происходит образование оксида металла при термическом разложении вещества?
Образование оксида металла при термическом разложении вещества происходит путем взаимодействия металла с кислородом воздуха при высоких температурах. В результате этого процесса металл окисляется, а кислород связывается с ним, образуя оксид металла.
Почему при термическом разложении вещества образуется оксид металла?
При термическом разложении вещества образуется оксид металла, так как происходит окисление металла в присутствии кислорода. При высоких температурах кислород активно взаимодействует с металлом, образуя соединение, которое и называется оксидом металла.
Какие металлы образуют оксиды при термическом разложении вещества?
Практически все металлы могут образовывать оксиды при термическом разложении вещества. Некоторые из наиболее распространенных металлов, образующих оксиды, включают алюминий, железо, медь, свинец, цинк, магний и др. Каждый металл образует свой собственный оксид, который имеет свои уникальные свойства и применения.
Какие свойства имеют оксиды металлов, образованные при термическом разложении вещества?
Оксиды металлов, образованные при термическом разложении вещества, обладают различными свойствами в зависимости от конкретного металла. Некоторые оксиды являются твердыми веществами, другие - газами или жидкостями. Они обладают разными цветами, такими как черный, красный, белый и др. Оксиды металлов также имеют разные степени растворимости в воде и кислотах. Они широко применяются в различных отраслях промышленности и науки.
