Атомы металлов являются основными строительными блоками металлических материалов, определяющими их уникальные свойства и химическую активность. Теория строения атомов металлов основана на принципах квантовой механики и позволяет объяснить множество физических и химических явлений.
Один из основных принципов теории строения атомов металлов - это их электронная структура. Атомы металлов состоят из ядра, образованного протонами и нейтронами, вокруг которого движутся электроны. Особенностью атомов металлов является наличие свободных электронов во внешнем энергетическом уровне, что обеспечивает металлическую связь и способствует формированию их уникальных свойств.
Квантовая механика позволяет описать вероятность нахождения электронов в определенных областях вокруг ядра. Моделирование строения атомов металлов основано на принципе запрета Паули, согласно которому каждый электрон в атоме должен занимать уникальное квантовое состояние. Благодаря этому принципу образуется электронная оболочка атома, состоящая из различных энергетических уровней и подуровней, на которых находятся электроны.
Изучение строения атомов металлов позволяет понять механизмы их взаимодействия с другими веществами, а также определить их физические и химические свойства. Знание основных принципов теории строения атомов металлов необходимо для разработки новых сплавов и материалов с улучшенными свойствами и качествами.
Основные принципы строения атомов металлов

1. Электронная оболочка: Основным принципом строения атомов металлов является наличие электронной оболочки, состоящей из электронов. Электроны располагаются на разных энергетических уровнях, называемых также электронными оболочками. Внешняя электронная оболочка, которая находится на самом большом энергетическом уровне, называется валентной оболочкой.
2. Подшелушечные электроны: Внешняя валентная оболочка атома металла содержит один или несколько электронов, которые могут свободно перемещаться между атомами. Эти электроны называются подшелушечными электронами и являются ответственными за общие свойства металлов, такие как проводимость электричества и тепла.
3. Решетка кристаллической структуры: Металлы имеют кристаллическую структуру, то есть атомы металлов упакованы в определенном порядке. Отличительной особенностью структуры металлов является наличие упорядоченной трехмерной решетки, в которой атомы занимают определенные позиции.
4. Металлическая связь: Металлическая связь является основным свойством металлов. Она возникает благодаря взаимодействию подшелушечных электронов с положительно заряженными ионами металлов. Под действием этих электронов металл приобретает высокую электропроводность и теплопроводность.
5. Металлы в данной Периодической таблице: Металлы располагаются слева от полупроводников и неметаллов в Периодической таблице элементов. Все элементы на левом краю таблицы являются металлами или имеют металлические свойства в определенных условиях.
6. Изменчивость свойств: Металлы обладают разнообразными свойствами, такими как высокая пластичность, прочность, блеск и способность образовывать сплавы с другими металлами. Величина этих свойств зависит как от вида металла, так и от его структуры и состава.
В целом, основные принципы строения атомов металлов включают наличие электронной оболочки, подшелушечных электронов, кристаллической структуры, металлической связи и разнообразных свойств. Эти принципы объясняют уникальные характеристики и поведение металлов, делая их одним из важнейших классов веществ в химии и материаловедении.
Строение атомов металлов: внешняя электронная оболочка и ядро

Атомы металлов состоят из ядра, которое содержит протоны и нейтроны, и электронной оболочки, в которой находятся электроны. Ядро атома находится в его центре и содержит положительно заряженные протоны и нейтроны без заряда. Протоны обладают положительным зарядом, а нейтроны не имеют заряда и находятся в ядре в качестве связывающих частиц.
Внешняя электронная оболочка атома металла состоит из электронов, которые находятся на более удаленных от ядра энергетических уровнях. Количество электронов в внешней оболочке определяет химические свойства металла. Также внешняя оболочка определяет способность атомов металлов образовывать связи с другими атомами и молекулами.
Ядро атома металла обладает положительным зарядом, который компенсируется отрицательным зарядом электронов внутренних энергетических уровней. Это делает атом металла в целом электрически нейтральным. Однако, когда атом металла образует связи с другими атомами, он может отдавать электроны из своей внешней оболочки, что приводит к образованию ионов металла с положительным зарядом.
Электронный обмен между атомами металлов
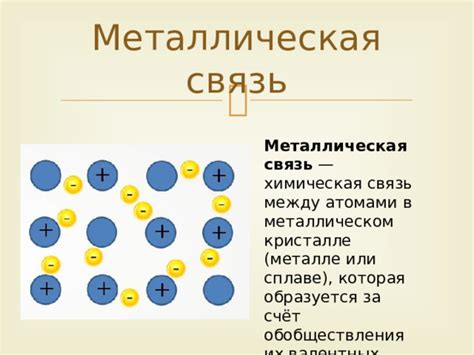
Электронный обмен между атомами металлов является основным механизмом, определяющим их структуру и свойства. Металлы характеризуются наличием свободных электронов внешних энергетических оболочек атомов, которые создают электронное облако вокруг этих атомов.
Электронный обмен между атомами металлов осуществляется посредством обмена свободных электронов. Он основывается на принципе, что атомы металла стремятся достичь более стабильного электронного состояния, образуя прочные межатомные связи. При этом свободные электроны перемещаются между атомами, что обеспечивает проводимость металлов и их высокую теплопроводность.
В результате электронного обмена между атомами металлов формируются так называемые электронные облака, которые обладают повышенной подвижностью и обуславливают основные свойства металлов, такие как хорошая проводимость электричества и тепла, пластичность и способность к формированию кристаллической решетки.
При электронном обмене между атомами металлов также происходит образование атомных ионов. Электроны, переходящие с одного атома на другой, могут создавать различные конфигурации ионов, которые определяют химическую активность и реакционную способность металлов. Электронный обмен также может приводить к образованию сплавов, в которых свободные электроны отвечают за стабилизацию и укрепление межатомной связи.
Металлическое связывание и его основные свойства

Металлическое связывание является одним из основных типов химической связи, характерного для металлов. В основе металлического связывания лежит образование сети положительно заряженных ионов металла, окруженных облаком свободно движущихся электронов.
Основные свойства металлического связывания:
- Электрическая проводимость: электроны, свободно движущиеся в металлической сети, могут легко передавать электрический ток. Именно поэтому металлы являются хорошими проводниками электричества.
- Теплопроводность: благодаря свободному движению электронов, металлы обладают высокой теплопроводностью. Они способны передавать тепловую энергию быстро и эффективно.
- Пластичность и деформируемость: металлическое связывание обеспечивает металлам высокую пластичность и деформируемость. Это значит, что они могут быть легко расплавлены, спрессованы, отливаться в разные формы и растягиваться без разрушения.
- Металлизация: металлы имеют способность отдавать электроны при взаимодействии с другими веществами, что является основой для процесса металлизации. Они способны образовывать сплавы с другими металлами и растворять в себе некоторые неметаллические элементы.
- Легкость и устойчивость в процессе окисления: металлы обладают способностью образовывать оксидные пленки на поверхности, которые защищают их от дальнейшего окисления. Это делает металлы устойчивыми к коррозии и обеспечивает им длительный срок службы.
Металлическое связывание играет ключевую роль в многих областях, включая металлургию, электронику и строительство. Понимание его основных свойств позволяет лучше понять и применять металлы в различных технологиях и промышленных процессах.
Структура и упаковка атомов металлов в кристаллической решетке
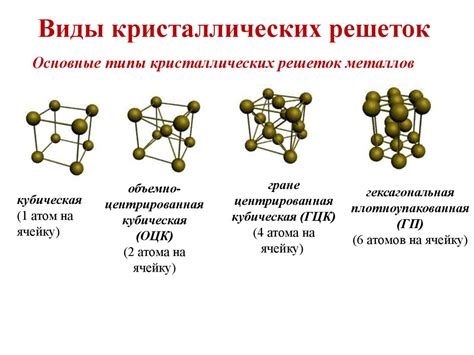
Металлы отличаются от других веществ своей кристаллической структурой, которая обусловлена особым расположением и упаковкой атомов внутри их решетки. Кристаллическая структура металлов обусловлена их специфическими свойствами, такими как пластичность, теплопроводность и электропроводность.
Обычно атомы металлов расположены в кристаллической решетке по особым принципам, которые определяют их стабильное положение. Для большинства металлов наиболее типичной является кубическая решетка, в которой атомы располагаются на узлах равномерной трехмерной сетки. Каждый атом окружен шестью ближайшими соседями, что обеспечивает стабильность кристаллической структуры.
Упаковка атомов в кристаллической решетке металлов может быть различной. Наиболее распространенные типы упаковки - "гранецентрированная кубическая решетка" и "гексагональная ближайшая упаковка". В гранецентрированной кубической решетке каждый атом окружен восьмью ближайшими соседями, а в гексагональной ближайшей упаковке - двенадцатью. Эти типы упаковки порождают специфические свойства металлов, так как их атомы могут легко скользить друг по другу.
Кристаллическая структура и упаковка атомов металлов являются основными факторами, определяющими их свойства и поведение в различных условиях. Изучение этих особенностей позволяет лучше понять механизмы деформации и упрочнения металлов, а также разработать новые материалы с улучшенными свойствами.
Вопрос-ответ

