Атом металла является основным строительным блоком металлического материала и играет важную роль в его свойствах и характеристиках. Атом металла состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, образуя его массу и заряд. Протоны имеют положительный заряд, а нейтроны не имеют зарядов. Электронная оболочка, в свою очередь, состоит из электронов, которые имеют отрицательный заряд и вращаются по орбитам вокруг ядра.
Одна из основных теоретических моделей строения атома металла - модель Юли-Томсона. Согласно этой модели, атом металла представлен как положительно заряженное ядро, окруженное облаком отрицательно заряженных электронов. В этой модели электроны рассматриваются как свободные частицы, перемещающиеся внутри металлической среды.
Однако с развитием квантовой механики было установлено, что электроны в атоме металла не перемещаются произвольно, а занимают определенные энергетические уровни. Таким образом, модель атома металла была уточнена с помощью модели Бора-Зоммерфельда. Согласно этой модели, электроны занимают дискретные орбиты вокруг ядра, которые характеризуются определенными энергетическими значениями.
Атом металла: определение и свойства
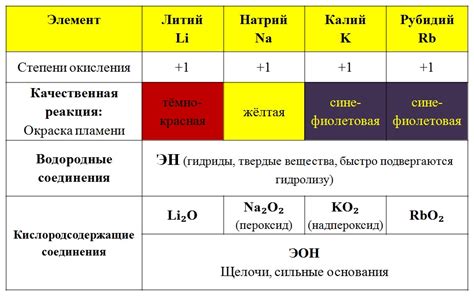
Атом металла – основная структурная единица металлического материала, состоящая из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а электронная оболочка состоит из электронов, образующих электронные облака вокруг ядра.
Металлические атомы обладают определенными свойствами, отличающими их от атомов других элементов. Одной из основных характеристик металлических атомов является их способность образовывать положительные ионы, отдавая свои электроны другим элементам. Это связано с небольшим количеством электронов в валентной оболочке металла, что делает процесс ионизации относительно легким.
Металлические атомы также обладают высокой проводимостью электричества и тепла. Это связано с свободными электронами, которые могут свободно перемещаться внутри металлической решетки. Данные свободные электроны ответственны за электропроводность и теплопроводность металлов.
Кроме того, металлические атомы обладают высокой пластичностью и текучестью. Это объясняется структурой и связями между атомами в металлической решетке. Эти свойства позволяют металлам легко поддаваться деформации и обладать высокой устойчивостью к разным механическим воздействиям.
В целом, атом металла является основным строительным элементом металлических материалов и обладает рядом уникальных свойств, определяющих их особенности и применение.
Структура атома металла
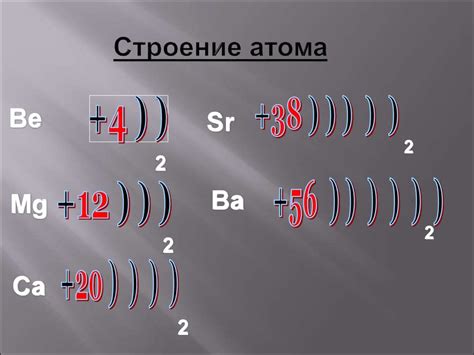
Атом металла состоит из ядра и электронной оболочки. Ядро представляет собой положительно заряженные протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Внутри ядра атома металла сосредоточена большая часть его массы.
Вокруг ядра находится электронная оболочка, состоящая из отрицательно заряженных электронов. Электроны образуют электронные облака, равномерно распределенные вокруг ядра. У электронов есть энергетические уровни или орбиты, на которых они могут находиться.
Электронные облака не равномерно распределены, а имеют определенную структуру. Структура электронной оболочки атома металла определяет его характеристики и свойства. Наиболее внешний энергетический уровень называется валентной оболочкой. Валентные электроны отвечают за химические свойства металла и его способность образовывать химические соединения.
В металлах валентная оболочка обычно содержит меньшее количество электронов, чем возможно установленное число. Это делает металлы хорошими проводниками электричества и тепла. Также структура валентной оболочки обуславливает металлический блеск, пластичность и другие свойства металлов.
Электронная оболочка атома металла
Электронная оболочка атома металла представляет собой внешнюю часть атома, которая содержит электроны. Она состоит из нескольких энергетических уровней или электронных оболочек. Каждая оболочка может вмещать определенное количество электронов, которые располагаются на различных орбиталях.
Орбитали представляют собой области пространства, в которых есть наибольшая вероятность обнаружить электрон. Электроны находятся на определенных энергетических уровнях, которые определяются ионизационным потенциалом атома металла. Каждый энергетический уровень может быть заполнен определенным числом электронов в соответствии с принципом Паули и принципом взаимного исключения.
Наиболее внешний энергетический уровень называется валентной оболочкой. Электроны на валентной оболочке называются валентными электронами и обладают наибольшей химической активностью. Они играют ключевую роль в химических реакциях и обеспечивают свойства металла, такие как проводимость электричества и тепла, пластичность и др.
Количество валентных электронов в атоме металла определяет его химические свойства и способность вступать в химические реакции. Например, атомы металлов с одним или двумя валентными электронами обычно образуют ионную связь со вторичными элементами, создавая структуры, такие как соли. Атомы металлов с несколькими валентными электронами могут образовывать ковалентные связи и обладать сложными структурами, такими как молекулы и полимеры.
Таким образом, электронная оболочка атома металла является важной составляющей его строения и характеризует его химические свойства и реакционную способность. Понимание структуры электронной оболочки помогает объяснить различные физические и химические свойства металлов и используется в науке и промышленности для разработки новых материалов и технологий.
Ядро атома металла
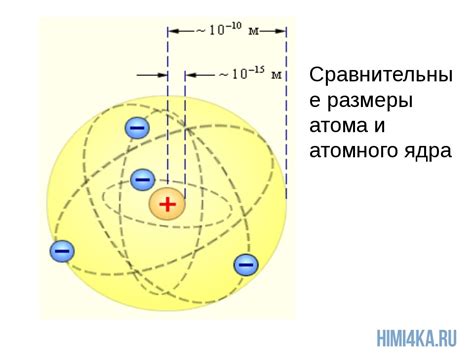
Ядро атома металла является его центральной частью и содержит большую часть его массы. Ядро состоит из протонов и нейтронов, которые называются нуклонами. Протоны имеют положительный заряд, а нейтроны не имеют заряда.
Количество протонов в ядре определяет атомный номер металла и определяет его химические свойства. Например, атом с одним протоном - водород, атом с 79 протонами - золото. Число нейтронов в ядре может варьироваться, образуя изотопы металла.
Ядро атома металла имеет очень высокую плотность, поскольку оно содержит большое количество нуклонов на небольшом пространстве. Протоны и нейтроны сильно взаимодействуют друг с другом, образуя ядерную силу, которая держит их вместе. Это сильная сила, которая является одной из основных фундаментальных сил в природе.
Ядро атома металла имеет очень маленький размер по сравнению с размером атома в целом. Это связано с тем, что большая часть объема атома занимается электронной оболочкой, которая содержит электроны. Таким образом, ядро является маленьким, но плотным и заряженным центром атома металла.
Ионизационная энергия атома металла
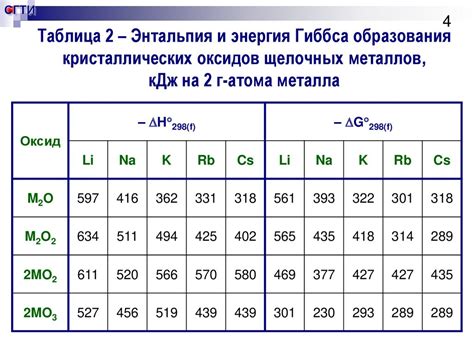
Ионизационная энергия атома металла - это энергия, которая требуется для отрыва электрона от атома металла, превращая его из нейтрального атома в ион. Ионизационная энергия является важной характеристикой атома металла, так как она определяет его реакционную способность и химические свойства.
Величина ионизационной энергии зависит от многих факторов, включая электронную конфигурацию атома, атомный радиус и эффективность экранирования ядра. В целом, ионизационная энергия металлов ниже, чем у неметаллов, что объясняется большим размером атома и меньшей привлекательной силой ядра к электронам.
Ионизационная энергия атома металла может быть измерена в электронвольтах (эВ) или килоджоулях на моль (кДж/моль). Более низкое значение ионизационной энергии указывает на то, что атом металла легко теряет электроны и образует положительно заряженные ионы, что является важным фактором во многих химических реакциях и процессах.
Ионизационная энергия атома металла имеет важное значение в технике и науке. Например, она часто используется для определения степени окисления металла в химических соединениях. Также, знание ионизационной энергии позволяет предсказать его взаимодействие с другими химическими веществами и использовать его в различных промышленных процессах.
Распределение электронной плотности в атоме металла
Атом металла является сложной системой, в которой электроны распределены вокруг ядра с определенной плотностью. Эта плотность электронов неоднородна и может быть представлена в виде трехмерной электронной плотности.
Распределение электронной плотности в атоме металла определяется как внешними электростатическими потенциалами (например, потенциалами других атомов или молекул), так и квантовыми эффектами, такими как принцип исключения Паули и осцилляционные энергии электронов.
Согласно принципу исключения Паули, каждый электрон в атоме занимает уникальное квантовое состояние, определенное четырьмя квантовыми числами (n, l, m, s). Это приводит к тому, что электроны занимают различные объемы пространства вокруг ядра и образуют облако электронной плотности, которое определяет форму атома металла.
Распределение электронной плотности в атоме металла может быть обнаружено с помощью различных экспериментальных методов, таких как рентгеновская дифракция, электронная спектроскопия и сканирующая зондовая микроскопия. Используя эти методы, ученые могут определить форму атома, его размеры, а также электронную структуру и плотность в различных областях атома.
Изучение распределения электронной плотности в атоме металла позволяет понять его свойства и поведение в различных условиях. Например, изменение электронной структуры может привести к появлению новых свойств, таких как магнитные или каталитические. Также электронная плотность играет важную роль в химических реакциях, так как взаимодействие атомов и молекул происходит через электронные облака.
Валентность атома металла и его связь с строением
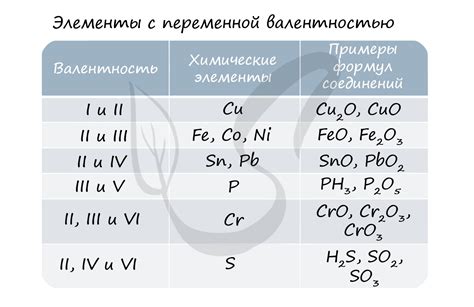
Валентность атома металла — это его способность образовывать связи с другими атомами, представляемыми неметаллами. Она определяется числом электронов, которые атом металла может потерять, отдать или разделить с другими атомами. Валентность определяет, какие ионы может образовывать металл и какие соединения с ним могут образовываться.
Валентность атома металла обычно связана с положением его электронов в энергетических уровнях или оболочках. Металлы имеют обычно несколько энергетических уровней, заполненных электронами. Внешнее энергетическое уровень, называемый валентной оболочкой, определяет валентность атома металла.
Валентность атома металла может быть представлена римскими цифрами, которые указывают, сколько электронов атом металла способен потерять или отдать при образовании связей с другими атомами. Например, если атом металла может потерять два электрона, валентность будет обозначаться римской цифрой II.
Валентность атома металла влияет на его способность образовывать различные типы химических связей и соединений. Металлы с различной валентностью могут образовывать ионы разного заряда, что определяет их участие в различных химических реакциях и способность образовывать разнообразные химические соединения.
Вопрос-ответ

Каково строение атома металла?
Атом металла состоит из ядра, в котором находятся протоны и нейтроны, а вокруг него располагаются электроны.
Что такое ядро атома металла и из чего оно состоит?
Ядро атома металла - это центральная часть атома, состоящая из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Ядро содержит большую часть массы атома и определяет его химические свойства.
