Температура плавления металлов является одним из фундаментальных свойств этих материалов. Это свойство определяется взаимодействием атомов в металлической решетке и ее структуре.
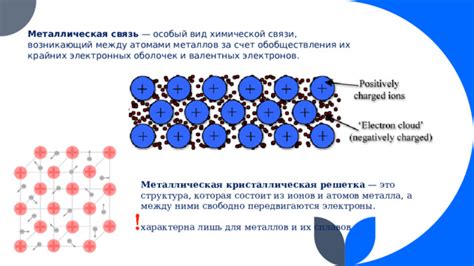
Металлы в основном состоят из положительных ионов, окруженных облаком свободных электронов. Именно связи между атомами и электронами обеспечивают металлам их уникальные свойства, включая высокую теплопроводность и электропроводность.
Как правило, температура плавления металлов выше, чем у других материалов, например, полимеров или керамики. Это связано с особенностями атомных связей в металлах. При повышении температуры атомы металла получают больше энергии и начинают вибрировать все интенсивнее. При достижении определенной температуры, называемой температурой плавления, атомы приобретают достаточную энергию для преодоления сил связи.
Температура плавления металлов зависит от различных факторов, включая тип металла, его кристаллическую структуру и примеси, наличие дефектов в решетке и давление. Например, чистые металлы обычно имеют более высокие температуры плавления, чем сплавы, поскольку примеси могут нарушать кристаллическую структуру и слабить атомные связи.
Связи между атомами определяют температуру плавления металлов
Температура плавления металлов является важным физическим свойством, определяющим их способность переходить из твердого состояния в жидкое при нагревании. Это свойство тесно связано с атомными связями, которые удерживают атомы металла в кристаллической решетке.
Атомы металлов образуют своеобразную "сетку", где каждый атом окружен ближайшими соседями. Силы притяжения, действующие между атомами, создают эти связи и определяют их прочность. Чем сильнее связь, тем выше температура плавления металла.
Связи между атомами в металлах можно классифицировать как металлические связи. Они формируются благодаря свободе перемещения электронов внутри кристаллической решетки, которая создает особую структуру, характерную для металлов. Электроны, образующие эти связи, могут двигаться по всей решетке, обеспечивая металлам их уникальные свойства, такие как электропроводность и теплопроводность.
Температура плавления зависит от силы металлических связей. Если связи между атомами слабые, металл будет иметь низкую температуру плавления. В то же время, если связи сильные, металл будет обладать высокой температурой плавления.
Понимание взаимосвязи между свойствами атомов, атомных связей и температурой плавления металлов играет важную роль в различных областях, таких как материаловедение, инженерия и металлургия. Изучение этих свойств позволяет улучшать и разрабатывать новые материалы с желаемыми физическими и химическими свойствами.
Атомные связи определяют температуру плавления металлов
Температура плавления металлов является ключевым параметром, определяющим их технические свойства и применение. Один из основных факторов, влияющих на температуру плавления металлов, - это тип и характер атомных связей, существующих между атомами металла.
Металлы имеют особую структуру, где атомы расположены в решетке, плотно упакованные друг к другу. Атомные связи в металлах образуются благодаря электростатическому притяжению между положительно заряженными ядрами атомов и подвижными электронами.
Температура плавления металлов связана с энергетическими характеристиками атомных связей. При нагревании металла, энергия теплового движения атомов увеличивается, что приводит к расширению этого движения и разрыву атомных связей.
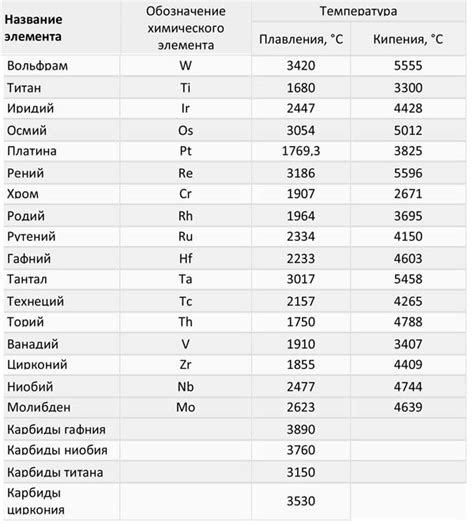
Таким образом, чем сильнее атомные связи в металле, тем выше температура плавления. Некоторые металлы, например, платина или иридий, обладают высокой температурой плавления из-за очень прочных атомных связей. В то время как другие металлы, такие как железо или свинец, имеют более низкую температуру плавления из-за более слабых связей.
Изучение атомных связей и их влияния на температуру плавления металлов позволяет улучшать их технические характеристики, разрабатывать новые сплавы и повышать эффективность различных процессов, связанных с обработкой металлов.
Температура плавления металлов зависит от атомных связей
Температура плавления металлов является важным физическим свойством, которое определяет их способность переходить из твердого состояния в жидкое. Это свойство в значительной степени зависит от характера атомных связей, существующих в структуре металлического материала.
Атомные связи в металлах обладают металлическим характером и основаны на так называемой электронной оболочке металла. В металлах электроны валентной оболочки образуют свободные электронные облака, которые могут свободно перемещаться внутри структуры металла. Именно эти свободные электроны отвечают за устойчивость атомов металла и обеспечивают его металлические свойства, включая высокую теплопроводность и электропроводность.
Температура плавления металлов связана с процессом нарушения атомных связей в их структуре. При повышении температуры атомы металла начинают передвигаться и колебаться вокруг своего положения в кристаллической решетке, что приводит к нарушению металлической структуры и отрыву свободных электронов от атомов. Это приводит к снижению прочности атомных связей и, в конечном итоге, к плавлению металла.
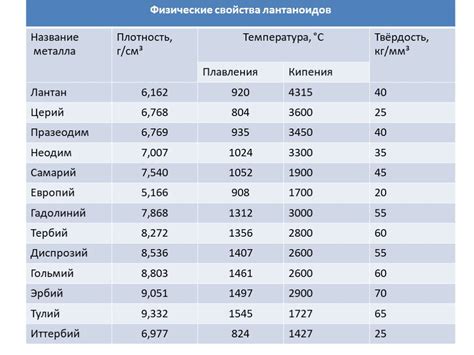
Температура плавления металлов различна и зависит от различных факторов, включая состав металла, форму его кристаллической решетки, наличие примесей и других физических параметров металлического материала. Например, железо плавится при температуре около 1538 градусов по Цельсию, в то время как алюминий плавится при температуре около 660 градусов по Цельсию. Понимание физических основ температуры плавления металлов позволяет контролировать их свойства и использовать их в различных областях промышленности и научных исследований.
Вопрос-ответ

Почему температура плавления металлов определяется атомными связями?
Температура плавления металлов определяется атомными связями, потому что именно атомы в металлах образуют кристаллическую решетку и взаимодействуют друг с другом. При повышении температуры атомы в металлах начинают получать больше энергии, что приводит к нарушению атомной решетки и переходу из твердого состояния в жидкое. Таким образом, температура плавления металлов определяется силой атомных связей.
Как атомные связи влияют на температуру плавления металлов?
Атомные связи влияют на температуру плавления металлов путем определения силы, необходимой для разрыва этих связей. Чем сильнее атомные связи, тем выше температура плавления, так как для перехода из твердого состояния в жидкое требуется больше энергии. Слабые атомные связи будут иметь более низкую температуру плавления, так как их разрыв будет требовать меньшего количества энергии.
В чем заключается связь между атомными связями и температурой плавления металлов?
Связь между атомными связями и температурой плавления металлов заключается в следующем: атомы металла формируют кристаллическую решетку, в которой они взаимодействуют друг с другом через атомные связи. С увеличением температуры атомы получают больше энергии и начинают двигаться, нарушая атомную решетку. Это приводит к переходу из твердого состояния в жидкое, то есть к плавлению. Таким образом, температура плавления металлов определяется силой атомных связей и степенью упорядоченности атомной решетки.
