Теллур - химический элемент с атомным номером 52 и символом Te в периодической системе элементов. Он относится к группе кальциогенов и имеет сходство с серой и селеном. Теллур является полуметаллом и может проявлять как металлические, так и неметаллические свойства.
Вопрос о том, является ли теллур кислотным или основным металлом, вызывает некоторое затруднение. С одной стороны, теллур может образовывать оксиды, которые реагируют с кислотами и образуют соли. Это говорит о его кислотном характере. С другой стороны, теллур может образовывать соединения с щелочными металлами, указывая на его основной характер. Таким образом, можно сказать, что теллур может проявлять как кислотные, так и основные свойства, в зависимости от условий реакции.
Исследования свойств теллура показывают, что в оксидно-щелочной среде теллур образует соединения с щелочными металлами, а в кислотной среде - с ионами металлов с большей валентностью. Это указывает на его способность к проявлению как кислотного, так и основного характера.
Таким образом, можно сделать вывод, что теллур является элементом с амфотерными свойствами, то есть способностью проявлять как кислотные, так и основные свойства, в зависимости от условий реакции. Это делает его уникальным и интересным объектом в химии и науке в целом.
Теллур - химический элемент являющийся парадоксом

Теллур (Te) - это химический элемент, который представляет собой металлоид с атомным номером 52 и массовым числом 127.6. Он обладает уникальными свойствами, которые делают его настоящим парадоксом в химии.
В своем химическом поведении теллур может как проявлять основные свойства, так и обнаруживать кислотные характеристики. Он может образовывать оксиды, которые обладают как основными, так и кислотными свойствами. Это своеобразное двойственное поведение делает теллур уникальным и интересным элементом.
Основные соли теллура, такие как гидроксид теллура (Te(OH)6), образуются при реакции с кислотами и обладают основными свойствами. Они растворяются в воде, образуя гидроксид-ионы и проявляют щелочные свойства.
С другой стороны, теллур также может образовывать кислотные соединения. Например, оксиды теллура (TeO2) и оксиангидрид теллурической кислоты (TeO3) являются кислотными соединениями и могут образовывать соли с щелочами.
Такое поведение теллура объясняется его положением в периодической системе элементов. Он находится между металлами и неметаллами и обладает свойствами обоих групп. Это делает его уникальным и интересным объектом изучения в химии.
Определение и свойства теллура

Теллур - это плохо проводящий металл химического элемента с атомным номером 52. Он является полуметаллом из группы кислородосодержащих элементов, и его химический символ Te.
Теллур обладает рядом уникальных свойств, которые делают его интересным для научных и промышленных исследований. Вот некоторые из них:
- Теллур обладает высокой электроотрицательностью, что делает его очень реактивным.
- Он обладает металлическим блеском и может быть отполирован до зеркального состояния.
- Теллур имеет низкую теплопроводность, что делает его полезным в промышленности для изоляции тепла и электричества.
- Он имеет высокую плотность и твердость, что делает его прочным материалом.
- Теллур образует разнообразные химические соединения, включая оксиды, сульфиды и галогениды.
Интересно, что теллур имеет специфическую способность проявлять фоторезистивные свойства при воздействии света. Это делает его полезным для создания фоточувствительных материалов в солнечных батареях и фотоэлементах.
Важно отметить, что теллур не является основным металлом, а является более близким к полуметаллам, таким как антимоний и сурьма. Однако, из-за своих химических свойств, теллур иногда используется в процессе лужения и отделки поверхностей различных металлов.
Место теллура в периодической таблице
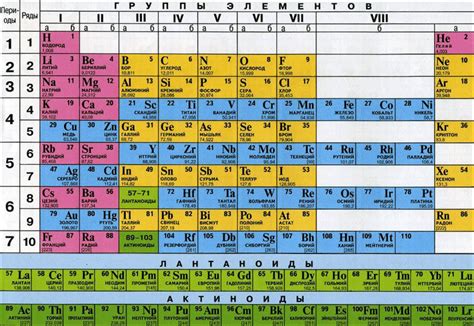
Теллур (Te) является химическим элементом с атомным номером 52 и относится к группе 16 (кислородные группы) периодической системы элементов. Он находится между селеном (Se) и иодом (I).
Теллур является полупроводником и имеет атомную массу около 127 единиц. Он обладает уникальными свойствами, такими как способность проводить электричество и тепло, а также хорошая устойчивость к окружающей среде.
Теллур находится в 5-й периоде периодической таблицы, что означает, что его электроны расположены в 5-м энергетическом уровне. Это делает его частью блока p элементов периодической таблицы, в котором находятся многие неметаллы, такие как кислород, сера и селен.
Теллур, особенно его соединения, имеет широкое применение в различных отраслях промышленности, включая производство стекла, полупроводников, солнечных батарей и керамики. Теллур также используется в некоторых медицинских препаратах и косметических продуктах.
В периодической таблице теллур находится вместе с другими элементами кислородной группы, которые имеют сходные химические свойства. Теллур обладает большей металлической характеристикой по сравнению с селеном и серой, что делает его интересным объектом для исследования в области различных приложений и технологий.
Химические свойства теллура
Теллур — химический элемент периодической системы симболом Te и атомным номером 52. Он является полуметаллом с атомной массой около 127 единиц и имеет серебристо-серый цвет. Химический элемент получил свое название от латинского слова "tellus", которое значит "Земля".
Химические свойства теллура проявляются в его реакционной способности. Теллур, будучи химическим элементом VI группы, образует соединения со многими другими элементами, в том числе с металлами и неметаллами. Он способен образовывать ковалентные связи и ионные связи, что дает ему возможность образовывать разнообразные соединения.
Теллур обладает способностью образовывать оксиды различных валентностей: TeO, TeO2, TeO3 и TeO4. Различные сочетания теллура и кислорода обладают разной степенью окислительности и растворимостью в воде. Например, оксид теллура(IV) (TeO2) обладает кислотными свойствами и образует теллуровую (тиллурную) кислоту (H2TeO3).
Теллур также образует гидриды с другими элементами, такие как теллуриды. Гидрид теллура (TeH2) является одним из наиболее значимых соединений теллура. Теллуриды представляют собой соединения теллура с металлами или полуметаллами и обладают различными свойствами. Некоторые теллуриды обладают полупроводниковыми свойствами и находят применение в электронике и оптоэлектронике.
Кислотные свойства теллура

Теллур – химический элемент с атомным номером 52 и символом Te в периодической системе элементов. Он относится к группе полуметаллов и характеризуется разнообразными свойствами. В частности, теллур обладает и кислотными свойствами, которые позволяют ему реагировать с различными кислотами.
Теллур может образовывать оксиды с разным степенями окисления, такие как TeO, TeO2 и TeO3. Они растворяются в воде, образуя кислые растворы. Такие растворы обладают кислотными свойствами и могут реагировать с щелочами для образования солей теллура.
Кроме того, теллур может образовывать соединения с кислородом, азотом и серой, которые также обладают кислотными свойствами. Например, соединение TeO2N2, известное как кислота теллура, имеет кислотные свойства и может реагировать с основаниями для образования солей.
Интересно отметить, что кислотные свойства теллура в значительной степени определяются его электронной структурой. Теллур имеет четыре электронных оболочки, в которых располагается 52 электрона. Учитывая такую сложную электронную структуру, теллур может образовывать разнообразные кислотные соединения с другими элементами.
Таким образом, теллур – полуметалл, обладающий кислотными свойствами. Эти свойства позволяют ему реагировать с различными кислотами и образовывать кислые соединения. Изучение таких свойств теллура имеет важное значение для развития химической науки и применения теллура в различных сферах.
Основные свойства теллура
Теллур - химический элемент с атомным номером 52 и символом Te в периодической таблице элементов. Он относится к группе шестого периода и металлам поэлементной таблицы D.I.Менделеева. Теллур обладает несколькими особыми свойствами, которые делают его уникальным в своем роде.
- Теллур является хрупким металлом с серебристым блеском.
- Он обладает очень низкой теплопроводностью и электропроводностью, что делает его хорошим изолятором.
- При нагревании он получает золотисто-желтую окраску и может плавиться при температуре около 450 °C.
- Теллур обладает полупроводниковыми свойствами и находит применение в солнечных батареях и электронике.
Интересно отметить, что теллур был одним из первых элементов, синтезированных искусственно, и его радиоактивные изотопы используются в медицине для диагностики и терапии рака.
- Теллур является частой примесью в сульфатах и селенатах и может быть токсичным для некоторых организмов.
- Биологическая роль теллура у людей и других организмов пока не полностью изучена.
- Теллур имеет много полиморфных структур и может образовывать различные соединения с другими элементами.
В целом, теллур является интересным и важным элементом в химии и науке, и его свойства продолжают быть предметом исследований и открытий.
Использование и применение теллура

Теллур – химический элемент с атомным номером 52 и символом Te в периодической таблице. Этот полуметалл имеет ряд важных применений и широкий спектр использования в различных областях науки, промышленности и медицине.
Промышленность:
- Теллур используется при производстве термоэлектрических материалов, которые находят применение в солнечных батареях, радиаторах и холодильниках.
- Его соединения используются в процессе производства стекла с высоким светопропусканием и стекла с электрооптическими свойствами.
- Теллурные соединения применяются в электронной промышленности, особенно при производстве полупроводниковых приборов.
Медицина:
- Теллур используется в радионуклидной диагностике при постановке и изучении рака щитовидной железы.
- Теллурные препараты могут быть использованы для лечения парацистита и геморроя.
Научные исследования:
- Теллурная чашка является важным элементом в процессе приготовления металлического теллура и его соединений.
- Теллур используется в качестве теплоемкого материала в экспериментах, связанных с исследованием низкотемпературной физики.
- Различные соединения теллура используются для создания стабильных металлогены и катализаторов, которые применяются в химических реакциях.
Теллур – это уникальный элемент, который находит применение в различных областях науки и промышленности благодаря своим уникальным свойствам и химической активности.
Выводы о химическом свойстве теллура

Теллур является химическим элементом с атомным номером 52 и обозначением Te. Он принадлежит к группе кислородсодержащих неметаллов и находится под селеном в периодической системе.
Одним из основных свойств теллура является его способность образовывать кислородсодержащие соединения. Теллур способен образовывать оксиды, селены и теллуры, которые проявляют как кислотные, так и щелочные свойства в растворах.
Также теллур способен реагировать с кислотой, образуя соли теллурия. Это свойство указывает на то, что теллур является кислотным металлом. Кроме того, теллур образует ряд неорганических кислот, таких как оксид теллура (IV), оксид теллура (VI) и теллуристовокислота.
Помимо этого, теллур также имеет возможность образовывать металл-связь с другими металлами. Например, соединение теллура с серебром обладает металлическими свойствами и образует кристаллическую структуру. Таким образом, теллур может рассматриваться как основной металл.
Вопрос-ответ

Что такое теллур?
Теллур - это химический элемент с атомным номером 52 и символом Te в периодической системе элементов. Он является полуметаллом, имеющим свойства как металлов, так и неметаллов.
Теллур - кислотный или основной металл?
Теллур не является ни кислотным, ни основным металлом. Он является полуметаллом и имеет сходные свойства как с металлами, так и с неметаллами.
Какие свойства теллура схожи с металлами?
Среди свойств теллура, схожих с металлами, можно выделить его хорошую электропроводность и теплопроводность. Теллур также способен образовывать ионы с положительным зарядом.
Какие свойства теллура схожи с неметаллами?
Свойства теллура, схожие с неметаллами, включают его низкую твердость, низкую плотность и недостаточную электропроводность при нормальных условиях. Теллур также может образовывать ионы с отрицательным зарядом.
Для чего используется теллур?
Теллур имеет ряд применений в различных областях. Например, он используется в производстве полупроводниковых материалов, в производстве стекла и керамики, а также в производстве пигментов для косметики и красок.
