Атомы металлов отличаются несколькими особенностями, которые делают их основными строительными блоками всех металлических материалов. Одна из главных особенностей – наличие большого количества свободных электронов. Это делает металлы отличными проводниками электричества и тепла. Свободные электроны представляют собой электрически заряженные частицы, которые могут свободно перемещаться по кристаллической решетке металла.
Структура атома металла также отличается от структуры атома других элементов. Атом металла состоит из ядра, которое содержит протоны и нейтроны, и электронной оболочки. Ядро находится в центре атома и содержит большую часть его массы. Электроны находятся на различных энергетических уровнях вокруг ядра.
Важной особенностью атомов металлов является их способность образовывать кристаллические решетки. Кристаллическая решетка представляет собой упорядоченное расположение атомов в трехмерном пространстве. В металлах атомы объединяются в структуры, называемые кристаллическими решетками, которые обеспечивают металлическим материалам их характерные свойства, такие как прочность и пластичность.
Важно отметить, что структура атома металла может существенно влиять на его химические свойства и поведение.
Таким образом, строение атомов металлов является ключевым фактором, определяющим их физические и химические свойства. Различия в структуре и упорядоченности атомов металлов приводят к различным свойствам металлических материалов и обуславливают их широкое применение в различных областях науки и промышленности.
Атомы и их роль в строении металлов
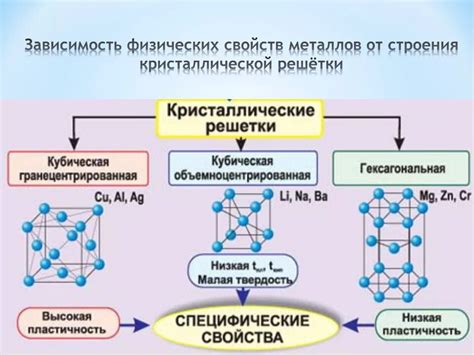
Атомы металлов играют важную роль в их строении и свойствах. Металлы являются кристаллическими веществами, в которых атомы располагаются в определенном порядке и образуют кристаллическую решетку.
Структура атомов в металлах отличается от структуры атомов в других веществах. Атомы металлов могут образовывать ионные связи, когда одни атомы отдают электроны другим, или связи между атомами могут быть металлическими, когда атомы обмениваются электронами и образуют электронную оболочку. Это позволяет металлам быть хорошими проводниками электричества и тепла.
Атомы металлов в кристаллической решетке образуют упорядоченную структуру, что позволяет металлам обладать механической прочностью и устойчивостью к деформации. Более того, атомы металлов могут образовывать межатомные связи, такие как металлические связи и связи в виде сетки, что придает металлам устойчивость к различным воздействиям и обеспечивает их долговечность.
- Именно благодаря особенностям строения атомов металлы обладают свойствами, как эластичность, пластичность и прочность. Это позволяет им быть использованными в различных сферах, начиная от строительства и заканчивая промышленностью.
- Строение атомов металлов также определяет их термические свойства. Металлы обладают высокой теплопроводностью и теплоемкостью, благодаря способности атомов обмениваться энергией между собой.
- Стоит отметить, что атомы металлов могут образовывать сплавы, когда в их кристаллическую решетку вступают атомы других металлов. Такие сплавы имеют особые свойства и могут быть использованы в различных областях, от электроники до авиации.
В целом, строение и свойства металлов тесно связаны с особенностями строения и взаимодействия атомов в их кристаллической решетке. Изучение этих особенностей позволяет создавать новые материалы и улучшать существующие, что находит применение в различных отраслях промышленности и науки.
Внешняя электронная оболочка металлических атомов
Внешняя электронная оболочка металлических атомов является одной из особенностей строения металлов. Она состоит из валентных электронов, которые находятся на самом внешнем энергетическом уровне атома. Валентные электроны в металлах обладают свободной подвижностью и могут легко перемещаться по кристаллической решетке металла.
Количество валентных электронов может быть разным у различных металлов и зависит от их положения в периодической системе элементов. Например, у щелочных металлов, таких как литий и натрий, внешняя электронная оболочка содержит один валентный электрон, что делает их химически активными и способными образовывать ионные связи.
Внешняя электронная оболочка металлических атомов также играет ключевую роль в определении физических свойств металлов. Эти электроны обеспечивают металлам характерные свойства, такие как электропроводность и теплопроводность. Именно благодаря свободным валентным электронам металлы могут легко передавать электрический ток и тепло.
Кроме того, внешние электроны металлических атомов отвечают за химическую активность и реакционную способность металлов. Они могут образовывать связи с другими атомами и ионами, образуя различные химические соединения. Взаимодействие внешних электронов металлических атомов с другими элементами определяет возможность образования сплавов и амалгам, что делает металлы важными материалами для различных промышленных областей.
Кристаллическая решетка металлов
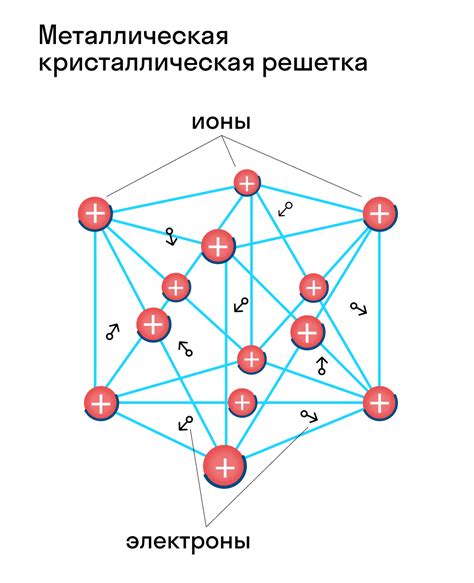
Кристаллическая решетка металлов - это упорядоченная структура, в которой атомы металла расположены в определенном порядке. Эта структура обладает регулярным повторением и характеризуется особыми свойствами металлов.
Металлы образуют кристаллическую решетку благодаря своей особенной структуре атомов. Атомы металла обладают свободными электронами, которые могут перемещаться внутри решетки. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью.
В кристаллической решетке металлов атомы металла могут быть упорядочены по различным схемам. Наиболее распространенная схема - кубическая решетка. В кубической решетке атомы металла расположены на вершинах и в центрах граней куба.
Кристаллическая решетка металлов может быть описана с помощью таких понятий, как элементарная ячейка, брауновское движение атомов и границы зерен. Элементарная ячейка - это наименьшая часть решетки, которая может повторяться в пространстве. Брауновское движение атомов приводит к изменению порядка в решетке, а границы зерен представляют собой области, где ориентация решетки изменяется.
Кристаллическая решетка металлов является одним из ключевых факторов, определяющих механические, электрические и тепловые свойства материалов. Поэтому изучение структуры металлической решетки имеет большое значение для разработки новых материалов с улучшенными свойствами.
Металлическая связь и межатомные взаимодействия

Металлическая связь является одной из основных особенностей строения атомов металлов. Ее суть заключается в том, что между атомами металла существуют свободные электроны, которые не принадлежат ни одному конкретному атому, а свободно перемещаются по кристаллической решетке металла. Эти свободные электроны образуют так называемое "море электронов", которое служит связующим звеном между атомами.
Межатомные взаимодействия в металлах можно разделить на два типа: внутримышечные взаимодействия и межмышечные взаимодействия. Внутримышечные взаимодействия возникают между атомами одного и того же металла и обеспечивают кристаллическую решетку металла. Эти взаимодействия осуществляются с помощью обмена электронами и образования ковалентных и ионных связей между атомами.
Межмышечные взаимодействия, или связи Делоне, возникают между атомами различных металлов и обеспечивают образование сплавов. Эти взаимодействия осуществляются за счет перемещения электронов между атомами различных металлов и образования общего "моря электронов".
Таким образом, металлическая связь и межатомные взаимодействия в металлах играют ключевую роль в определении их свойств. Благодаря этим особенностям, металлы обладают высокой электропроводностью, теплопроводностью, пластичностью и множеством других уникальных свойств, которые делают их одними из наиболее важных материалов в технологии и промышленности.
Особенности электронной структуры металлов

Электронная структура металлов отличается от электронной структуры других веществ и имеет несколько особенностей.
- Металлы обладают высокой электропроводностью благодаря наличию свободных электронов в зоне проводимости. Эти электроны легко перемещаются по кристаллической решетке металла и придают ему способность проводить электрический ток.
- В металлах обычно присутствует так называемая "металлическая связь", при которой электроны не привязаны к отдельным атомам, а свободно двигаются по всей структуре металла. Это объясняет высокую пластичность и плавучесть металлов.
- У металлов относительно малое количество электронов в валентной оболочке. Это позволяет атомам металлов образовывать легко отдельные катионы и участвовать в химических реакциях.
Металлы имеют высокую теплопроводность и теплоемкость, что связано с наличием свободных электронов и возможностью их передвижения. Это объясняет способность металлов быстро нагреваться и охлаждаться.
Электронная структура металлов также влияет на их оптические свойства. Некоторые металлы имеют яркий блеск, так как свободные электроны поглощают энергию света и рассеивают ее в виде отраженного света. Это явление называется металлическим блеском.
В целом, электронная структура металлов определяет их физические и химические свойства, делая их одной из наиболее важных и полезных групп веществ в мире.
Металлические свойства, обусловленные строением атомов
Металлы обладают рядом уникальных свойств, которые обусловлены особенностями их атомного строения.
- Электронная структура: у атомов металлов внешний энергетический слой (валентный слой) содержит малое количество электронов. Это позволяет атомам металлов легко отдавать или принимать электроны, образуя положительные и отрицательные ионы.
- Электропроводимость: благодаря свободным электронам в металлической решетке, металлы способны проводить электрический ток. Электроны приложенного напряжения легко перемещаются между атомами, создавая электрическую проводимость.
- Теплопроводность: свободные электроны в металле также обеспечивают его высокую теплопроводность. При нагревании электроны переносят энергию от более нагретых участков к холодным, обеспечивая равномерное распределение тепла.
- Пластичность: благодаря слабости связей между атомами в металлической решетке, металлы обладают высокой пластичностью. Атомы могут свободно перемещаться относительно друг друга без повреждения кристаллической структуры.
- Магнитные свойства: некоторые металлы могут обладать магнитными свойствами. Это связано с наличием неспаренных электронов на валентном слое, которые создают магнитные моменты.
В целом, металлические свойства обусловлены специфическим строением атомов металлов, что позволяет им проявлять уникальные физические и химические особенности.
Влияние строения атомов на физические и химические свойства металлов

Строение атомов металлов является одной из ключевых характеристик, определяющих их физические и химические свойства. Атомы металлов обладают особенной структурой, которая в значительной мере влияет на их поведение в различных условиях.
Прежде всего, атомы металлов обладают особой способностью образовывать кристаллическую решетку. Эта структура позволяет металлам обладать многими полезными свойствами, такими как высокая прочность, теплопроводность и электропроводность.
Кристаллическая решетка металлов состоит из слоев атомов, которые имеют особую упаковку. Внутри каждого слоя атомы металлов тесно упакованы друг к другу и образуют регулярные структуры. Это обеспечивает высокую прочность металла и его способность к деформации без разрушения.
Кроме того, строение атомов металлов также влияет на их химические свойства. Атомы металлов имеют особое расположение электронов, что делает их способными к образованию ионов положительной заряды. Благодаря этому, металлы обладают высокой химической активностью и способностью к образованию соединений с другими элементами.
В заключение, строение атомов металлов играет важную роль в формировании их физических и химических свойств. Кристаллическая решетка обеспечивает металлам высокую прочность и способность к деформации, а особое расположение электронов делает их химически активными и способными к образованию соединений. Понимание строения атомов металлов позволяет улучшить их свойства и разрабатывать новые материалы с определенными характеристиками.
Вопрос-ответ

Каковы основные особенности строения атомов металлов?
Основные особенности строения атомов металлов заключаются в наличии большого количества свободных электронов у внешней оболочки атомов. Это позволяет металлам обладать свойствами хорошего проводника электричества и тепла, а также образовывать ковкие и блестящие поверхности.
Что представляет собой внутреннее строение атомов металлов?
Внутреннее строение атомов металлов состоит из ядра, которое содержит протоны и нейтроны, и оболочек, в которых находятся электроны. Число протонов в атоме определяет его заряд, а число электронов равно числу протонов, что делает атом электрически нейтральным.
Почему у атомов металлов большое количество свободных электронов?
У атомов металлов большое количество свободных электронов из-за своеобразной структуры их электронных оболочек. Внешняя оболочка атома металла содержит от одного до трех электронов, что делает ее относительно слабой и позволяет легко отрывать эти электроны. Такие атомы называются ионами. Отрываясь от атома, электроны образуют свободную электронную спираль, которая может передавать энергию в виде электрического тока или тепла.
Как внутреннее строение атомов металлов влияет на их свойства?
Внутреннее строение атомов металлов с большим количеством свободных электронов влияет на их свойства. Благодаря наличию свободных электронов, атомы металлов могут образовывать кристаллические решетки, которые придают металлам их характерные физические и механические свойства, такие как блеск, ковкость, прочность, хорошая электрическая и теплопроводность.
Какие еще особенности строения атомов металлов можно выделить?
Особенности строения атомов металлов также включают малое количество электронов в внешней оболочке, что делает металлы склонными к образованию ионов и хорошими проводниками электричества и тепла. Кроме того, атомы металлов могут образовывать различные сплавы, объединяясь с другими металлами.
