Изучение электрохимических свойств различных металлов позволяет нам понять, каким образом они взаимодействуют в химических реакциях. Однако существуют определенные комбинации металлов, которые не могут быть использованы вместе из-за их отрицательного электродного потенциала.
Определение электродного потенциала металла является важным показателем его химической активности и способности к окислению или восстановлению. В таблицах потенциалов представлены значения электродных потенциалов металлов относительно стандартного водородного электрода (SHE). При этом положительные значения обозначают способность металла к окислению, а отрицательные - к восстановлению.
Запрещенные комбинации металлов в таблицах потенциалов связаны с возможностью возникновения коррозии. Если два металла находятся в электрическом контакте и имеют разные значения электродных потенциалов, то металл с более низким значением будет подвержен коррозии, так как будет выступать в роли анода, а металл с более высоким значением - в роли катода. Данное явление может привести к быстрой деструкции и разрушению металлических конструкций, что неприемлемо во многих сферах применения.
Понятие и значение таблиц потенциалов металлов
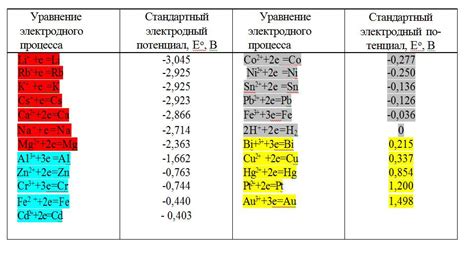
Таблицы потенциалов металлов представляют собой справочник, который указывает на потенциалы окисления металлов относительно стандартного водородного электрода. Эти данные играют важную роль в химических и электрохимических процессах, так как они позволяют предсказывать потенциальные реакции между различными металлами и их соединениями.
Зная потенциалы окисления металлов, можно определить их активность и вероятность происхождения химических реакций. Главным образом, таблицы потенциалов металлов используются для предсказания коррозии металлов. Коррозия, являющаяся нежелательным процессом, может приводить к значительным повреждениям или разрушению металлических конструкций и изделий.
Таблицы потенциалов металлов позволяют определить металлы, которые могут образовывать гальванические пары с высокой коррозионной активностью. Наличие таких пар может привести к различным типам коррозии, таким как питтинг, поверхностная и межкристаллическая коррозия. Эти данные помогают инженерам и конструкторам выбирать компоненты и материалы, которые будут использоваться в различных условиях с целью предотвращения коррозии и увеличения долговечности конструкций.
Однако следует отметить, что таблицы потенциалов металлов не являются единственным фактором, определяющим коррозионную активность металлов. Другие факторы, такие как окружающая среда, температура, концентрация растворенных веществ и присутствие других металлов, также оказывают влияние на коррозионные процессы. Поэтому для получения более точных данных о коррозионной активности металлов рекомендуется использовать совокупность информации, включая таблицы потенциалов металлов и другие справочные данные.
Описание таблицы потенциалов металлов
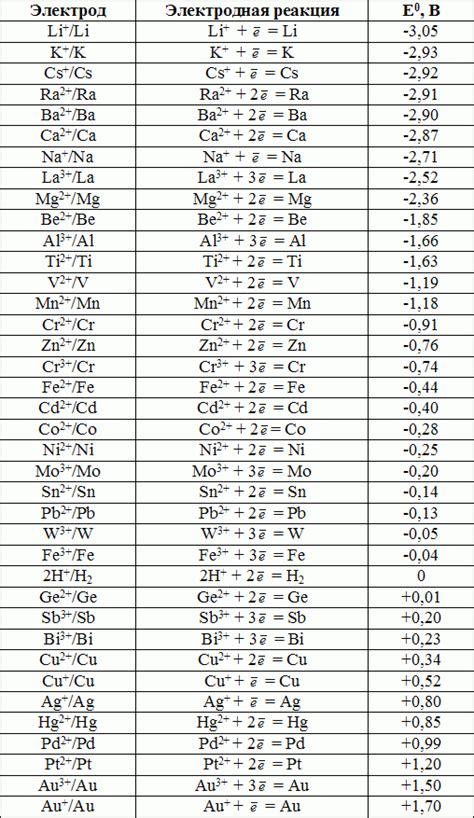
Таблица потенциалов металлов – это важный инструмент, который используется при изучении электрохимических процессов и исследовании коррозии металлов. Данная таблица содержит набор данных, которые позволяют определить, как реагирует один металл при контакте с другим.
В таблице потенциалов металлов каждому металлу присваивается относительное значение его потенциала окисления или восстановления. Таким образом, можно определить, какой металл будет восстанавливаться, а какой окисляться при взаимодействии электролита или другого металла.
Значения потенциалов металлов в таблице сравниваются с потенциалом стандартного электрода водорода (принимается за ноль). Если потенциал металла в таблице положительный, то он является анодом и будет подвергаться окислению. Если же потенциал отрицательный, то металл является катодом и будет подвергаться восстановлению.
Основываясь на значениях потенциалов металлов в таблице, можно определить, какие комбинации металлов нежелательны или даже запрещены в электрохимических или коррозионных процессах. Например, если в таблице потенциалов указано, что высокий потенциал металла A и низкий потенциал металла B, то комбинация этих двух металлов может привести к активной коррозии металла B.
Таблица потенциалов металлов является важным справочным материалом для химиков, инженеров и ученых, помогающим им прогнозировать электрохимические процессы, выбирать материалы для конкретных условий и предотвращать нежелательные химические реакции.
Значение таблицы потенциалов металлов для химических процессов
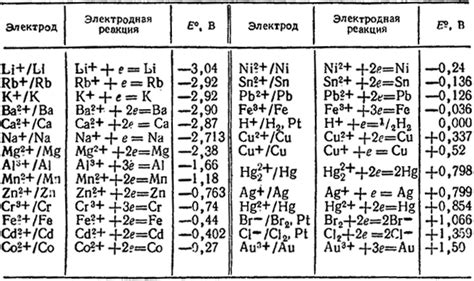
Таблица потенциалов металлов является важным инструментом для химических процессов, так как позволяет определить возможность реакций их окисления и восстановления. Каждый металл имеет свой потенциал, который определяет его способность отдавать или принимать электроны.
Значение потенциала металла позволяет определить его активность в реакциях, а также возможность возникновения коррозии и образования гальванических элементов. Например, если металл имеет отрицательный потенциал, то он склонен принимать электроны и восстанавливаться, а если потенциал положительный, то металл склонен отдавать электроны и окисляться.
Близкое значение потенциалов металлов указывает на их схожесть в химическом отношении и возможность проведения реакций взаимного окисления и восстановления. С другой стороны, большая разница в потенциалах может привести к возникновению коррозии и разрушению материала.
Для удобства сравнения потенциалов металлов используется стандартный электрод - водородный электрод, к которому сравниваются остальные металлы. Таким образом, значение потенциала водорода равно нулю, и относительные потенциалы металлов определяются по отношению к нему.
Таблица потенциалов металлов широко используется в химической и электротехнической промышленности, в научных исследованиях и при проведении экспериментов. Она помогает оценить возможность и характер реакций, предсказать электрохимическую активность металлов и выбрать оптимальные условия проведения химических процессов.
Роль запрещенных комбинаций металлов в таблицах потенциалов
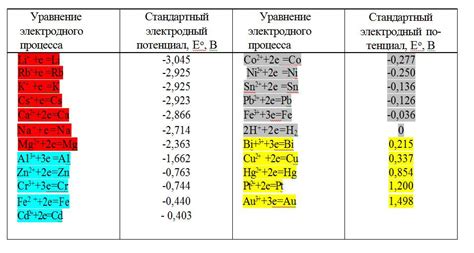
Запрещенные комбинации металлов играют важную роль в таблицах потенциалов, которые используются для оценки степени агрессивности окружающей среды на различные материалы. Эти таблицы содержат информацию о потенциале окисления различных металлов, что помогает определить, будет ли происходить коррозия или другая форма деградации материала при контакте с другими металлическими элементами.
Запрещенные комбинации металлов указывают на сочетания, при которых возможна высокая вероятность повреждения и разрушения материала. Такие комбинации могут вызывать гальваническую коррозию, которая возникает при контакте различных металлических элементов в присутствии электролита. В результате этого процесса один металл выступает в роли анода, который окисляется, а другой металл выступает в роли катода, который восстанавливается.
Изучение таблиц потенциалов и запрещенных комбинаций металлов является важным шагом при выборе материала для конкретного применения. Это позволяет предвидеть возможность возникновения коррозии и принять соответствующие меры для защиты материала. Кроме того, знание запрещенных комбинаций металлов помогает в процессе проектирования и изготовления металлических конструкций, снижая вероятность их повреждения и увеличивая их долговечность.
Важно отметить, что не все комбинации металлов являются запрещенными. Некоторые пары металлов могут быть безопасными и не вызывать коррозии. Однако, в случае с несовместимыми металлическими элементами, которые образуют запрещенные комбинации, особенно в условиях высокого уровня влажности или наличия активных химических сред, возможности коррозии увеличивается.
- Запрещенные комбинации металлов могут быть различными для разных сред и условий эксплуатации.
- Таблицы потенциалов металлов облегчают выбор материала и проектирование конструкций с учетом предотвращения коррозии.
- Знание запрещенных комбинаций металлов помогает предотвратить повреждение конструкций и обеспечить их долговечность.
Описание запрещенных комбинаций металлов
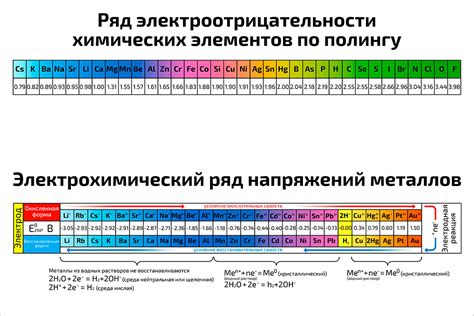
Запрещенные комбинации металлов в таблицах потенциалов играют важную роль в понимании реакций окисления и восстановления в химических системах. Эти комбинации определены на основе наблюдений и исследований, позволяющих предсказать, насколько эффективными будут окислительные или восстановительные процессы при сочетании определенных металлов.
Знание запрещенных комбинаций металлов важно в различных областях, включая химическую промышленность, электроэнергетику, металлургию и другие. Неправильное сочетание металлов может привести к нежелательным реакциям, таким как коррозия или образование токсичных веществ.
Основным принципом запрещенных комбинаций металлов является то, что металлы с более низким потенциалом окисления будут окисляться металлами с более высоким потенциалом окисления. Например, если сочетать металл с положительным потенциалом окисления с металлом с отрицательным потенциалом окисления, процесс окисления будет происходить более интенсивно.
Различные таблицы потенциалов металлов содержат информацию о запрещенных комбинациях. В них указаны пары металлов, между которыми реакция окисления и восстановления происходит очень быстро и интенсивно. Например, комбинация металлов, таких как медь и цинк, будет неприемлема из-за высоких потенциалов окисления и восстановления.
Запрещенные комбинации металлов ценны для понимания химических реакций и выбора правильных материалов для конкретных приложений. Использование этих знаний помогает предотвратить нежелательные последствия и обеспечить успешное функционирование химических систем, которые взаимодействуют с металлами.
Последствия использования запрещенных комбинаций металлов

Использование запрещенных комбинаций металлов в различных промышленных и технических процессах может привести к серьезным последствиям и проблемам.
Во-первых, запрещенные комбинации металлов могут вызывать коррозию и разрушение материалов. Коррозия — это процесс, при котором металлы взаимодействуют с окружающей средой, что приводит к их разрушению. Использование запрещенных комбинаций металлов увеличивает вероятность возникновения коррозии, что может привести к повреждению и отказу оборудования, структур и конструкций.
Во-вторых, запрещенные комбинации металлов могут вызывать электрохимические реакции, такие как гальваническая коррозия. Гальваническая коррозия происходит, когда металлические материалы с разными потенциалами взаимодействуют в присутствии влаги или электролита. Это может привести к более интенсивному процессу коррозии и значительному ухудшению качества и долговечности материалов.
Кроме того, использование запрещенных комбинаций металлов может оказывать негативное влияние на здоровье людей и окружающую среду. Некоторые металлы могут быть токсичны и накапливаться в организмах живых существ, что может привести к различным заболеваниям и экологическим проблемам.
В целях безопасности и здоровья пользователей и окружающей среды, необходимо строго соблюдать рекомендации и требования по использованию разрешенных комбинаций металлов в соответствующих отраслях и сферах деятельности. При проектировании и разработке новых изделий и технологий необходимо учитывать потенциальные риски и проблемы, связанные с использованием запрещенных комбинаций металлов.
Вопрос-ответ

Какие запрещенные комбинации металлов есть в таблицах потенциалов?
В таблицах потенциалов химических элементов запрещены комбинации металлов, у которых величина потенциала разности электродов отрицательна.
Почему запрещены комбинации металлов с отрицательной разностью потенциалов?
Запрещены комбинации металлов с отрицательной разностью потенциалов, так как в этих комбинациях будет происходить электрохимическое окисление металла с более низким потенциалом, что может вызвать коррозию и разрушение системы.
Какие вредные последствия могут быть при использовании запрещенных комбинаций металлов?
При использовании запрещенных комбинаций металлов могут возникать вредные электрохимические реакции, которые приводят к коррозии и разрушению системы. Это может привести к потере функциональности, ухудшению качества работы и даже поломке оборудования.
Какие металлы часто образуют запрещенные комбинации с другими металлами?
Запрещенные комбинации металлов часто образуются, например, при использовании алюминия с магнием, железа с медью, ртутного электрода с любым металлом. Эти комбинации имеют отрицательную разность потенциалов и могут привести к электрохимическим реакциям с плохими последствиями.
Какие меры предпринимаются, чтобы избежать использования запрещенных комбинаций металлов?
Для избежания использования запрещенных комбинаций металлов, производители и инженеры разрабатывают специальные материалы, покрытия и обработки, которые уменьшают или исключают риск нежелательных электрохимических реакций. Также разрабатываются таблицы потенциалов и рекомендации по выбору материалов для конкретных условий эксплуатации.
