Металлы – это элементы, которые обладают способностью проводить электрический ток и имеют характерные блеск и металлический глянец. Каждый атом металла имеет заряд ядра, окруженного электронами. Заряд ядра определяет химическое поведение и свойства атома металла.
Заряд атомов металлов может быть положительным или отрицательным. Если атом имеет большее количество протонов, чем электронов, он будет иметь положительный заряд. В таком случае, атом считается ионом, а его заряд обозначается числом со знаком "+". Если атом имеет меньшее количество протонов, чем электронов, он будет иметь отрицательный заряд. В таком случае, атом также считается ионом, а его заряд обозначается числом со знаком "-".
Таблица зарядов атомов металлов представляет собой перечень различных металлов и их соответствующие заряды. Некоторые металлы имеют фиксированный заряд, например, натрий всегда имеет заряд "+1", а калий – "+1". Однако у некоторых металлов заряд может варьироваться в зависимости от условий и среды. Например, железо может иметь заряд "+2" или "+3".
Заряды атомов металлов в таблице
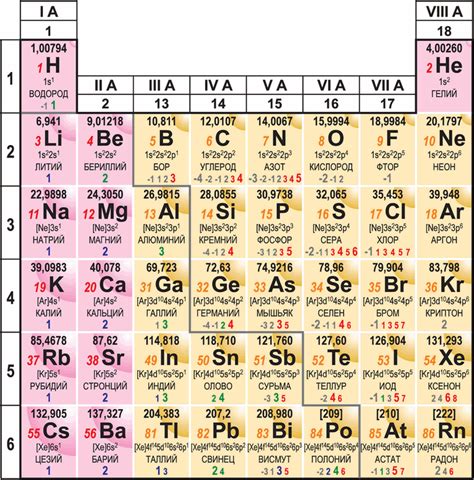
Таблица зарядов атомов металлов позволяет установить взаимодействие этих элементов друг с другом и с другими веществами. Заряд атома металла влияет на его свойства и поведение в химических реакциях. В таблице приводятся значения зарядов атомов металлов, отражающие их способность отдавать или принимать электроны.
Заряд атома металла может быть положительным или отрицательным, в зависимости от того, какой электронный уровень является последним заполненным. В таблице зарядов атомов металлов указывается знак и величина заряда, а также элементы, к которым они относятся.
Некоторые металлы имеют фиксированный заряд, например, Na+ (натрий), Al3+ (алюминий), Fe2+ (железо) и другие. Другие металлы могут иметь несколько возможных зарядов, например, Cu+ и Cu2+ (медь). В таких случаях в таблице указываются оба значения заряда.
Заряды атомов металлов в таблице являются неизменными и служат основой для понимания и прогнозирования химических свойств металлов. Зная заряд атома металла, можно сделать выводы о его реакционной способности, способности образовывать соединения с другими элементами и многое другое.
Сменные величины заряда у атомов металлов
Заряд атомов металлов может изменяться в зависимости от внешних условий и окружающей среды. Это свойство называется сменным зарядом. Сменные величины заряда у атомов металлов возникают из-за наличия свободных электронов, которые могут перемещаться между атомами.
Сменные величины заряда у атомов металлов играют важную роль в химических реакциях. Благодаря этим зарядам металлы могут проявлять различные свойства, например, возможность образования ионов с разными зарядами или способность проводить электрический ток.
Сменные заряды у атомов металлов могут быть представлены в виде таблицы. Например, для переходных металлов такая таблица может содержать информацию о возможных величинах зарядов в соответствии с их электронной конфигурацией и реактивностью. Это помогает химикам понять и предсказывать поведение и свойства различных металлов.
Сменные величины заряда у атомов металлов также могут определяться взаимодействием с другими элементами или соединениями. Например, металлы могут образовывать ионы разных зарядов в реакции с кислородом или неорганическими кислотами. Это также может быть связано с действием внешних факторов, таких как температура или давление.
Вопрос-ответ

Каково значение заряда атомов металлов в таблице?
Значение заряда атомов металлов в таблице указывается в единицах элементарного заряда.
Какие металлы представлены в таблице зарядов атомов?
В таблице зарядов атомов представлены различные металлы, включая железо, медь, алюминий, цинк, свинец и другие.
Какие факторы влияют на величину заряда атомов металлов?
Величина заряда атомов металлов зависит от количества электронов во внешней оболочке атома и от его положения в периодической таблице.
Почему в таблице указывается только одно значение заряда атомов металлов?
В таблице указывается только одно значение заряда атомов металлов, так как оно является средним значением для данного металла.
