Металлы - это особый класс химических элементов, обладающих специфическими свойствами и способностью взаимодействовать с другими веществами. Их характеристики и реакции могут быть представлены в виде таблицы, которая отображает сведения о их электронной структуре, химическом состоянии, степени активности и реакционных способностях. Такая таблица является удобным инструментом для изучения и понимания взаимодействия металлов в химических процессах.
Одной из основных характеристик металлов является их электронная структура. Металлы обладают множеством свободных электронов во внешней оболочке, что позволяет им образовывать ионы с положительным зарядом и участвовать в реакциях. Электроны, находящиеся в зоне проводимости, осуществляют электропроводность металлов и их способность к теплопроводности.
Взаимодействие металлов с различными веществами может приводить к различным химическим реакциям. Например, взаимодействие с кислородом может привести к окислению металла и образованию оксидов. Взаимодействие с водой может привести к образованию гидроксидов и выделению водорода. Также металлы могут образовывать соли с кислотами, растворяться в различных растворителях и проявлять другие химические свойства.
Таблица химических свойств и реакций металлов позволяет систематизировать и визуально представить информацию о характеристиках различных металлов. Это помогает не только понять принципы взаимодействия металлов, но и применять их свойства в различных сферах науки и промышленности, таких как производство металлических изделий, электротехника, химическая промышленность и многие другие.
Таблица химических свойств и реакций металлов

Металлы являются основными строительными блоками Вселенной и играют важную роль в обычной жизни человека. Они обладают уникальными химическими свойствами и способностью проводить тепло и электричество. Таблица химических свойств и реакций металлов позволяет систематизировать информацию о различных химических реакциях, в которых металлы могут участвовать.
Одной из основных характеристик металлов является способность образовывать ионы положительной зарядности. Это связано с их электронной структурой, при которой внешняя оболочка электронов неполная и легко отдает электроны при взаимодействии с другими веществами. Это позволяет металлам участвовать в реакциях с кислотами, основаниями и другими веществами.
Металлы могут образовывать различные химические соединения, в том числе оксиды, галогениды и соли. Они также могут образовывать комплексные соединения с органическими и неорганическими соединениями. Некоторые металлы, такие как железо и медь, способны каталитически активировать различные реакции, обладая при этом высокой стабильностью и долговечностью.
Таблица химических свойств и реакций металлов помогает систематизировать информацию о взаимодействии металлов с различными веществами и определить их основные химические свойства. Она является неотъемлемым инструментом для студентов, ученых и любителей химии, позволяющим углубить знания о металлах и их взаимодействии с окружающей средой.
Алкалий
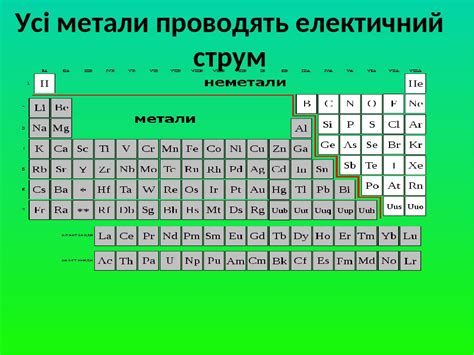
Алкалии - первая группа элементов периодической системы химических элементов, включающая в себя литий, натрий, калий, рубидий, цезий и франций. Названа так из-за того, что ее элементы образуют щелочные оксиды и гидроксиды.
Физические свойства:
- Алкалий представляют собой металлы серебряного цвета, имеющие низкую плотность и низкую температуру плавления.
- Они хорошо проводят тепло и электричество.
- Алкалии легко реагируют с водой, кислородом и другими не металлами.
- У них малая твердость и легкость в сплавах.
Химические свойства:
- Алкалии активно реагируют с водой, образуя щелочные оксиды и гидроксиды.
- Они образуют соли с кислотами, в результате чего образуется вода.
- Алкалии реагируют с кислородом, восстанавливая его оксиды.
- Взаимодействуют с неметаллами, образуя соответствующие с ними соединения.
Применение:
- Ряд алкалиевых металлов используется в производстве щелочей, мыла и стекла.
- Натрий широко применяется в пищевой промышленности.
- Калий используется как удобрение в сельском хозяйстве.
- Алкалии используются в качестве катодного материала в щелочных батареях.
Взаимодействие металлов алкалий с различными веществами демонстрирует их активность и способность образовывать новые соединения, что делает их важными элементами в химической промышленности.
Щелочно-земельные металлы

Щелочно-земельные металлы - это группа химических элементов в периодической системе, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они относятся к щелочным металлам и обладают рядом общих химических свойств.
Щелочно-земельные металлы имеют малую электроотрицательность и поэтому вступают в реакции с другими веществами. Они образуют стабильные соединения с кислотами, окисляющими веществами и неметаллами. Кроме того, они обладают хорошей проводимостью электричества и тепла.
Бериллий является легким и прочным металлом, который имеет высокую плотность, жесткость и температуру плавления. Магний обладает низкой плотностью и используется в производстве легких сплавов. Кальций, стронций и барий обладают свойствами щелочных металлов, но их реактивность и химические свойства отличаются от железо-группы.
Щелочно-земельные металлы, в основном, применяются в промышленности и научных исследованиях. Например, магний используется в производстве авиационных сплавов, строительных материалов и лекарственных препаратов. Кальций широко используется в строительстве, производстве стекла и сельском хозяйстве.
Переходные металлы

Переходные металлы - это элементы, которые находятся в середине периодической таблицы Менделеева, между левыми и правыми металлами. Они отличаются особыми химическими свойствами, которые делают их полезными в различных областях науки и промышленности.
Одной из особенностей переходных металлов является их способность образовывать ионы с различными степенями окисления. Это связано с наличием внутренней оболочки d-электронов, которая может менять свою заполненность при взаимодействии с другими элементами.
Переходные металлы обладают высокой проводимостью электрического тока и тепла, что делает их необходимыми материалами для изготовления различных электрических и термических устройств. Они также обладают высокой прочностью и твердостью, что позволяет использовать их в производстве различных изделий и механизмов.
Многие переходные металлы образуют соединения с кислородом, обладающие яркими цветами. Это связано с наличием d-электронов, которые поглощают определенные длины волн света и излучают остальные, создавая видимый спектр цветов.
Некоторые переходные металлы являются катализаторами реакций, облегчая химические превращения без участия себя в самих реакциях. Это делает их важными компонентами в различных промышленных процессах, таких как производство пластиков, удобрений, лекарств и других веществ.
В таблице химических свойств и реакций переходных металлов можно найти информацию о их химическом составе, физических свойствах, реактивности и многом другом. Эта таблица является важным инструментом для изучения и понимания химии переходных металлов и их применения в различных областях науки и технологии.
Легкие металлы

Легкие металлы - это группа элементов, которые характеризуются низкой плотностью и значительной химической активностью. Они обладают свойством легко реагировать с кислородом, влагой и другими веществами.
Примером легкого металла является алюминий. Этот металл имеет низкую плотность и отличается высокой проводимостью электричества. Он также обладает стойкостью к коррозии и является одним из наиболее распространенных металлов в мире. Алюминий широко применяется в различных отраслях промышленности, включая авиастроение, строительство и электронику.
Другим примером легкого металла является магний. Этот элемент обладает низкой плотностью и хорошей стойкостью к коррозии. Магний обычно используется в производстве легких автомобилей, военной техники и прочих продуктов.
Еще одним легким металлом является литий. Этот элемент обладает низкой плотностью и хорошей проводимостью тепла и электричества. Литий используется в батареях, лекарствах, стекле и других продуктах. Он также является важным компонентом для производства ядерных реакторов и атомных бомб.
Вывод: легкие металлы - это группа элементов с низкой плотностью и активной химической реактивностью. Алюминий, магний и литий являются примерами таких металлов и находят широкое применение в различных отраслях промышленности.
Полуметаллы

Полуметаллы или металлоиды - это элементы, которые обладают свойствами как металлов, так и неметаллов. Они занимают промежуточное положение между металлами и неметаллами в периодической таблице химических элементов.
Одним из наиболее известных полуметаллов является кремний (Si). Он широко используется в производстве полупроводников, благодаря своим полупроводниковым свойствам. Кремний также является составной частью кремнезема, который применяется в строительстве и производстве стекла.
Другим примером полуметалла является германий (Ge). Германий также используется в производстве полупроводников и солнечных батарей. Он обладает схожими химическими свойствами с кремнием.
Антимоний (Sb) - еще один полуметалл, который имеет широкое применение. Он используется в производстве огнезащитных материалов, противомикробных соединений и в производстве аккумуляторов.
Другие полуметаллы включают в себя теллур (Te), который применяется в производстве полупроводников и солнечных батарей, и полоний (Po), который является радиоактивным элементом и применяется в некоторых исследованиях и в производстве радиоактивных источников.
Лантаноиды
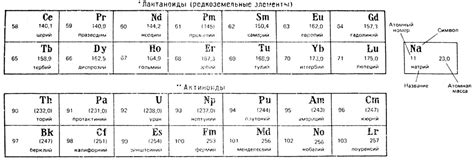
Лантаноиды – это группа металлов, которые следуют после лантания в периодической системе элементов. Всего в группу входит 14 элементов: церий, прасеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций.
Лантаноиды обладают сходными химическими свойствами и образуют специфические соединения. Они являются мягкими металлами, обладают благородным серым цветом и хорошей магнитной характеристикой.
Реакции лантаноидов с водой происходят вспышками, с выделением водорода. Они также реагируют с кислородом, нитратами, соляными кислотами и щелочами.
Лантаноиды имеют широкое применение в различных отраслях промышленности. Например, церий используется в катализаторах и для придания цвета стеклу и керамике. Неодимовые магниты являются самыми сильными перманентными магнитами, они широко используются в электронике и медицине. Европий и тербий используются для производства люминесцентных красителей для телевизионных экранов и энергосберегающих ламп.
Актиноиды

Актиноиды - группа элементов периодической системы, которые дополняют серию лантанидов и следуют за элементом лантаном. Всего в серии актиноидов находится 15 элементов, начиная с актиния (Ac) и заканчивая лоренцием (Lr).
Актиноиды обладают рядом характерных свойств, среди которых высокая плотность, ярко выраженная радиоактивность и способность образовывать стабильные соединения со многими элементами. Самым известным актиноидом является уран (U), который широко используется в ядерной энергетике.
Взаимодействие актиноидов с другими металлами может происходить через химические реакции, образуя различные соединения. Например, актиноиды могут образовывать комплексные соединения с органическими кислотами или солями, что делает их полезными для промышленности и научных исследований.
Актиноиды также могут проявлять свойства радиоактивных элементов, которые могут быть опасными для живых организмов. Поэтому при работе с актиноидами необходимо соблюдать все меры безопасности и контролировать уровень радиоактивности в окружающей среде.
Вопрос-ответ

Какие реакции возможны при взаимодействии металлов?
При взаимодействии металлов могут происходить различные реакции, такие как окисление, восстановление, образование солей и газов. Например, металлы могут окисляться кислородом воздуха, образуя оксиды, или восстанавливать ионы металлов из их растворов. Также металлы могут реагировать с кислотами, образуя соли и выделяя водородный газ.
Какие вещества могут вступать в реакцию с металлами?
Металлы могут вступать в реакцию с кислородом воздуха, водой, кислотами, щелочами и другими растворами, а также с солями и органическими веществами. Например, реакции с водой приводят к образованию оснований и выделению водорода, реакции с кислотами — к образованию солей и выделению водородного газа.
Какие металлы реагируют с кислородом воздуха?
Некоторые металлы реагируют с кислородом воздуха, образуя оксиды. Например, железо образует оксид железа (III), алюминий — оксид алюминия, калий — оксид калия. Эти реакции называются окислением металлов.
Какие металлы реагируют с кислотами?
Некоторые металлы реагируют с кислотами, образуя соли и выделяя водородный газ. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка и выделяя водородный газ. Алюминий реагирует с серной кислотой, образуя сульфат алюминия и выделяя водородный газ. Эти реакции называются реакциями образования соли.
Какие продукты образуются при реакции металлов с водой?
При реакции металлов с водой образуется основание и выделяется водородный газ. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водородный газ. Калий реагирует с водой, образуя гидроксид калия и выделяя водородный газ. Эти реакции являются реакциями образования основания.
