Взаимодействие металлов с окислительными кислотами является важной областью химической науки. Окислительные кислоты, такие как серная, азотная и хлорная, имеют способность окислять металлы. Эта реакция может привести к разрушению металлической структуры и образованию новых соединений. Важно изучать таблицу взаимодействия металлов с окислительными кислотами, чтобы предсказать реакцию и предотвратить возможные негативные последствия.
Таблица взаимодействия металлов с окислительными кислотами представляет собой систематическое описание реакций, которые происходят между металлами и оксидами этих кислот. Основываясь на таблице, можно определить, какой металл будет успешно взаимодействовать с различными окислительными кислотами и какие продукты реакции будут образовываться.
Таблица включает в себя различные металлы, отсортированные по их активности. Наиболее активные металлы могут реагировать с окислительными кислотами, образуя соли и выделяя водород. Менее активные металлы могут не реагировать с некоторыми окислительными кислотами или реагировать медленнее. Таким образом, таблица помогает определить, какие металлы можно использовать в различных химических процессах и какую осторожность следует соблюдать при взаимодействии металлов с окислительными кислотами.
Окислительные кислоты и металлы
Окислительные кислоты — это кислоты, которые способны окислять вещества, делая их более высокоокисленными. Они играют важную роль в химических реакциях, в том числе взаимодействии с металлами.
Взаимодействие металлов с окислительными кислотами может приводить к различным химическим реакциям и образованию соединений. Некоторые металлы проявляют большую активность при контакте с окислительными кислотами и могут даже реагировать с ними с горением или выделением газов.
Например, активные металлы, такие как натрий и калий, реагируют с концентрированной серной кислотой, вызывая выделение водорода и образование солей металлов:
- 2Na + H2SO4 → Na2SO4 + H2
- 2K + H2SO4 → K2SO4 + H2
Другие металлы, такие как железо и цинк, могут реагировать с разбавленной серной кислотой, образуя соответствующие соли металлов и выделяя водород:
- Fe + H2SO4 → FeSO4 + H2
- Zn + H2SO4 → ZnSO4 + H2
Некоторые металлы, например, серебро и золото, реагируют с окислительными кислотами очень медленно или практически не реагируют. Это связано с их низкой активностью и устойчивостью к окислению.
Таким образом, взаимодействие металлов с окислительными кислотами зависит от их химической активности и может приводить к различным реакциям с образованием солей и выделением водорода или других газов.
Окислительные кислоты
Окислительные кислоты - это кислоты, которые могут присутствовать в составе реагентов и химических соединений и обладают способностью окислять другие вещества.
Одним из наиболее распространенных примеров окислительных кислот является серная кислота (H2SO4), которая широко используется в промышленности в качестве реагента и катализатора. Эта кислота обладает сильными окислительными свойствами и способна окислять многие органические и неорганические вещества.
Другим примером окислительных кислот является перманганат калия (KMnO4), который часто используется в химическом анализе в качестве окислителя. Он имеет ярко-фиолетовую окраску и обладает сильными окислительными свойствами.
Окислительные кислоты играют важную роль в различных процессах, таких как окисление металлов, получение водорода и производство электрической энергии. Они также являются важной составной частью многих химических реакций и процессов, которые происходят в природе и в промышленности.
Окислительные кислоты часто применяются в лабораторных условиях для проведения химических экспериментов и исследований. Их использование требует осторожности и соблюдения безопасности, так как они могут быть опасными для здоровья и окружающей среды.
Металлы и их взаимодействие
Металлы – это химические элементы, которые обладают хорошей электропроводностью, а также способностью образовывать катионы при окислении. Одной из важных характеристик металлов является их способность взаимодействовать с окислительными кислотами, такими как соляная кислота, серная кислота и азотная кислота.
Взаимодействие металлов с окислительными кислотами может протекать с различной степенью интенсивности. Например, некоторые металлы, такие как алюминий и цинк, реагируют с окислительными кислотами довольно активно, высвобождая при этом водород. Другие металлы, например, серебро и золото, обладают низкой активностью и почти не реагируют с окислительными кислотами.
Важно отметить, что металлы могут быть различным образом устойчивы к воздействию окислительных кислот. Некоторые металлы, такие как железо, медь и свинец, могут вступать в реакцию с окислительными кислотами, но при этом образуют защитную пленку, которая предотвращает дальнейшее разрушение металла. Другие металлы, такие как натрий и калий, реагируют с окислительными кислотами без образования защитной пленки, что приводит к значительной потере металла.
Таблица взаимодействия металлов с окислительными кислотами позволяет определить степень интенсивности взаимодействия каждого металла с конкретной окислительной кислотой. Это помогает учитывать особенности химических реакций и выбирать наиболее подходящие металлы для различных технологических процессов, таких как производство и хранение химических соединений.
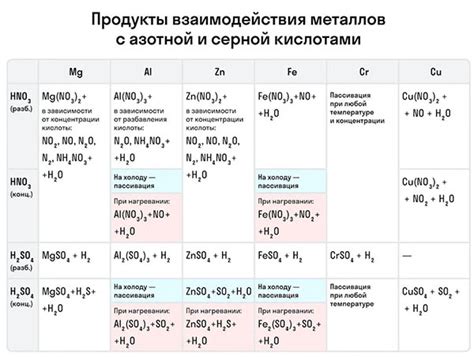
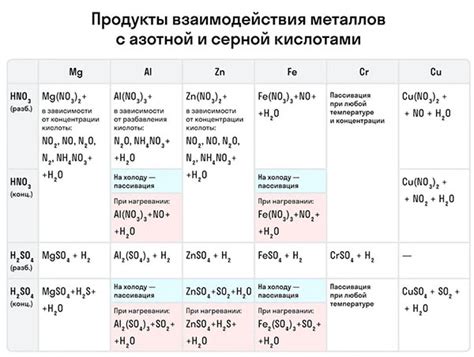
Таблица взаимодействия металлов с окислительными кислотами

Окислительные кислоты могут реагировать с различными металлами, образуя соли и газы. Эти реакции могут протекать с различной силой и интенсивностью, в зависимости от химических свойств металла и кислоты.
Таблица взаимодействия металлов с окислительными кислотами помогает систематизировать данную информацию и определить, какой металл будет реагировать с определенной кислотой.
В таблице приводятся различные металлы и окислительные кислоты, а также указывается, будет ли реакция между ними протекать или нет. Для обозначения реакций между металлами и кислотами используются специальные символы:
- +
- -
- ~
Знак "+" указывает на то, что реакция между металлом и кислотой протекает с выделением газа. Знак "-" указывает на то, что реакция не протекает. Знак "~" указывает на то, что реакция может протекать, но с меньшей интенсивностью, чем реакции с другими металлами.
Таблица взаимодействия металлов с окислительными кислотами является важным инструментом в изучении химических реакций и может быть полезна при проведении опытов или анализе химических процессов.
Основные группы металлов
Металлы делятся на несколько основных групп в зависимости от их поведения при взаимодействии с окислительными кислотами. Существуют химически активные металлы, такие как натрий, калий, кальций, железо и цинк. Они легко реагируют с окислительными кислотами, образуя соли и выделяя водород.
Вторая группа металлов – это менее активные металлы, такие как медь, свинец, алюминий и никель. Они тоже способны реагировать с окислительными кислотами, но не так быстро и интенсивно, как химически активные металлы. При этом они также образуют соли и выделяют водород.
Некоторые металлы, такие как серебро и золото, не реагируют с окислительными кислотами. Они химически инертны и не образуют солей или выделяют водород при контакте с кислотами. Эти металлы обычно применяются в ювелирном и электронном производстве, где их химическая инертность очень ценится.
Также существуют группы металлов, которые реагируют с некоторыми специфическими окислительными кислотами, но не с другими. Например, алюминий реагирует с соляной кислотой, образуя хлорид алюминия и выделяя водород, но не реагирует с серной кислотой. Это связано с различием в электрохимической активности разных окислительных кислот и их взаимодействием с определенными металлами.
Все эти особенности взаимодействия металлов с окислительными кислотами имеют большое значение в химической промышленности, а также в различных отраслях науки и техники. Знание этих химических свойств позволяет эффективно использовать металлы в различных процессах и производствах.
Металлы и окислительные кислоты
Металлы и окислительные кислоты обладают сложным взаимодействием, которое может быть как положительным, так и отрицательным. Окислительные кислоты могут оказывать как химическое, так и физическое воздействие на металлы.
Окислительные кислоты, взаимодействуя с металлами, могут вызывать реакции, такие как окисление, выделение газов и образование солей. Некоторые металлы обладают способностью активно реагировать с окислительными кислотами, например, щелочные металлы, такие как натрий и калий. Они проявляются вспышкой света и выделением водорода при контакте с кислотой.
Однако не все металлы взаимодействуют с окислительными кислотами одинаково. Некоторые металлы, такие как золото и платина, не реагируют с кислотами, поскольку они являются химически инертными. Некоторые металлы, такие как железо и алюминий, могут реагировать с кислотами, но только при наличии определенных условий, таких как концентрация кислоты и наличие воды.
Взаимодействие металлов с окислительными кислотами имеет важное практическое применение. Многие индустриальные процессы, такие как гальваническое покрытие, производство аккумуляторов и очистка металлов, основаны на реакциях металлов с окислительными кислотами. Кроме того, понимание взаимодействия металлов с окислительными кислотами помогает предсказывать и контролировать коррозию металлов, что имеет важное значение в области строительства и промышленности.
Выводы:
- Металлы и окислительные кислоты взаимодействуют, вызывая различные реакции.
- Некоторые металлы активно реагируют с кислотами, выделяя газы и окисляясь.
- Некоторые металлы являются химически инертными и не реагируют с окислительными кислотами.
- Понимание взаимодействия металлов с окислительными кислотами имеет практическое применение в индустрии и помогает предсказывать и контролировать коррозию металлов.
Реакции взаимодействия
Металлы могут взаимодействовать с окислительными кислотами, образуя соответствующие соли и выделяя водород. Эти реакции являются типичными проявлениями окислительных свойств кислот и восстановительных свойств металлов.
Например, при взаимодействии железа с соляной кислотой образуется хлорид железа, а выделяющийся водород воспламеняется при прикосновении к открытому огню или источнику искры. При реакции алюминия с соляной кислотой также образуется хлорид алюминия, но выделяющийся водород не горит.
Реакции взаимодействия металлов с окислительными кислотами могут осуществляться не только с образованием солей, но и с образованием еще одного продукта - сульфатов. Например, при реакции меди с серной кислотой образуется сульфат меди, а выделяющийся водород может быть заметен по появлению пузырьков воздуха.
Вопрос-ответ

Какая таблица существует для описания взаимодействия металлов с окислительными кислотами?
Существует таблица, называемая таблицей взаимодействия металлов с окислительными кислотами. Она представляет собой систематическое описание реакций, которые происходят при взаимодействии различных металлов с окислительными кислотами.
Какие данные можно найти в таблице взаимодействия металлов с окислительными кислотами?
В таблице взаимодействия металлов с окислительными кислотами можно найти информацию о том, какой металл реагирует с какой окислительной кислотой и какие соединения образуются в результате реакции. Кроме того, можно узнать, какой газ выделяется в процессе реакции и какие условия необходимы для ее осуществления.
Какие свойства металлов влияют на их взаимодействие с окислительными кислотами?
Взаимодействие металлов с окислительными кислотами зависит от их электрохимических свойств. Металлы, обладающие большей активностью, более легко реагируют с окислительными кислотами. Кроме того, взаимодействие может зависеть от степени окисления металла и других факторов, таких как концентрация и температура кислоты.
Какие практические применения имеет таблица взаимодействия металлов с окислительными кислотами?
Таблица взаимодействия металлов с окислительными кислотами имеет практическое применение в химической промышленности, лабораторных исследованиях и образовании. Она помогает предсказать результаты реакции между металлом и окислительной кислотой, что может быть полезно при разработке новых процессов и материалов, а также при проведении химических экспериментов и демонстраций.
